Продукція
Препарати зареєстровані в Україні
УДК: 615.273.53; 615.243.4
Магнікор - ефективний та безпечний препарат вітчизняного виробництва для профілактики серцево-судинних захворювань
Г.В. Зайченко, О.В. Файзуллін
Національний фармацевтичний університет
У статті проаналізовані дані наукової літератури стосовно патогенетичної обґрунтованості, ефективності та безпечності застосування ацетилсаліцилової кислоти в якості ан- тиагреганта у лікуванні та профілактиці серцево-судинних захворювань. Стаття містить короткий аналіз вітчизняного ринку препаратів ацетилсаліцилової кислоти, що застосовують у кардіологічній практиці, та рекомендації практичного характеру щодо оптимізації вибору конкретного препарату. Значну увагу автори присвятили аналізу даних про вплив лікарської форми препаратів ацетилсаліцилової кислоти та складу комбінованих засобів, що її містять, на фар- макокінетичні параметри та профіль їхньої безпечності. На підставі наведених даних автори статті вважають, що одним з найбезпечніших та найефективніших препаратів ацетилсаліцилової кислоти для застосування в кардіології, які представлені сьогодні на ринку України, є вітчизняний комбінований препарат Магнікор, що окрім ацетилсаліцилової кислоти містить у своєму складі антацидний компонент - магнію гідрооксид.
Ключові слова: антиагреганти, ацетилсаліцилова кислота, безпечність нестероїдних протизапальних засобів, антациди, магнію гідрооксид.
За статистичними даними різноманітні клінічні форми серцево-судинної патології діагностують більше ніж у 20% працездатного населення європейських країн, а в структурі загальної захворюваності на її частку припадає приблизно 40% усіх випадків. В Україні серцево-судинні захворювання (ССЗ) є причиною 63% усіх смертей, з них понад 60% смертей серед осіб похилого віку. Попри те що ССЗ залишаються найважливішою причиною непрацездатності і смертності дорослого населення розвинених країн, у більшості з них протягом останніх десятиліть спостерігається певна тенденція до зменшення їхнього значення у загальному об’ємі захворюваності. В Україні протягом кількість населення із ССЗ постійно зростає [17]. Зазначене вище підкреслює гостроту та величезну соціальну значущість проблеми забезпечення контролю поширеності ССЗ та їхніх наслідків.
Відомо, що розвиток найрізноманітніших серцево-судинних і цереброваскулярних розладів, таких, як ішемічна хвороба серця (ІХС), інфаркт міокарда (ІМ), порушення мозкового кровообігу та ішемічний інсульт тісно пов’язані з процесами тромбоутворення [6, 24]. Ці процеси особливо активно виявляються у разі дестабілізації току крові у судинах: у звуженій атеросклеротичною бляшкою ділянці судини виникає прискорений турбулентний потік, що зумовлює пошкодження та розвиток дисфункції ендотелію. Тромбоцити контактують із субендотеліальними структурами ушкодженої судинної стінки, що спричинює їхню активацію та призводить до наступної агрегації та адгезії [6, 13, 43].
Активація тромбоцитів здійснюється за участі катехо- ламінів, тромбіну, АДФ, серотоніну, колагену, та тромбокса- ну А2 (ТхА2), останній є продуктом ЦОГ-залежного шляху перетворення арахідонової кислоти. У результаті активації тромбоцитів відбувається вивільнення з біологічно активних речовин (АДФ, ТхА2, серотоніну) і активація за їхньою участю глікопротеїдних рецепторів IIIa/IIb, що є рецепторами фібриногену. Агрегація тромбоцитів відбувається при активації і взаємодії IIIa/IIb через утворення фибринових містків між тромбоцитами [25, 34].
Таким чином, активація тромбоцитів є однією з найважливіших ланок у патогенезі серцево-судинних ускладнень, що багато в чому визначає вираженість мікроциркуляторних порушень у життєво важливих органах (серце, головний мозок) і периферійних тканинах. Отже, застосування антиагре- гантної терапії патогенетично обґрунтоване і дозволяє розглядати її в якості важливої складової схем лікування різних форм ІХС, атеросклерозу, порушень мозкового кровообігу, цукрового діабету і профілактики вторинних ускладнень. Відповідно до стандартів лікування антиагреганти призначають при ІХС з метою попередження ускладнень та покращення прогнозу поряд з іншими засобами (статини, інгібітори АПФ, ß-блокатори) [13, 19, 41].
Серед препаратів, які застосовують для профілактики тромбогенних ускладнень варто особливо відзначити засоби, що містять у своєму складі ацетилсаліцилову кислоту (АСК), - ефективний та один з найдетальніше вивчених ан- тиагрегантів.
Універсальний механізм фармакологічної дії АСК та нестероїдних протизапальних засобів (НПЗЗ) полягає у пригніченні циклооксигенази (ЦОГ). Саме пригнічення ЦОГ-опосередкованого синтезу простаноїдів (простагландинів, простациклінів і тромбоксанів) є головним механізмом, що визначає як фармако-, так і токсикоди- намічний профіль даних препаратів [54].
Відомо, що синтез простаноїдів здійснюється у два етапи: спочатку за участю ЦОГ відбувається перетворення арахідонової кислоти на проміжні продукти (простагландини Н2), кінцеве перетворення забезпечується тромбоксан-, простациклін- та простагландинсинтетазами з утворенням відповідних кінцевих активних продуктів залежно від фенотипу клітин.
Доведено існування в організмі людини двох ізоформ ЦОГ: ЦОГ-1 і ЦОГ-2, структура яких кодується відповідними генами. Вважається, що ЦОГ-1, яка є конститутивним ферментом, відповідальна за синтез тромбоксанів у тромбоцитах та визначає базальний рівень простагландинів в інших тканинах. У той самий час ЦОГ-2 експресується макрофагами, синовиоцитами, фібробластами, гладкою судинною мускулатурою, хондроцитами і ендотеліальними клітинами після індукції цитокінами або факторами росту, тобто є інду- цибельним ферментом. Значення ЦОГ-2 для організму полягає в її участі у процесі запалення, а пригніченням її активності деякими фармакологічними агентами пояснюють протизапальний ефект. Крім того, вважається, що саме ЦОГ-2 відповідальна за продукцію простацикліну (антагоністу тромбоксанів) в ендотелії судин [16].
Слід зазначити, що не всі препарати, які пригнічують ЦОГ, виявляють однакову спорідненість до її різних ізо- форм, це визначає особливість їхнього фармакологічного ефекту і токсикодинаміки. Так, відповідно до сучасних уявлень, для АСК є характерною вибірковість дії по відношенню до ЦОГ-1, проте селективність дії будь-яких фармакологічно активних агентів є відносною та залежить від дози. Отже, у відносно низьких дозах (50-300 мг/добу) АСК відрізняється значним ступенем селективності по відношенню до ЦОГ-1, а ії превалюючим фармакодинамічним ефектом є антиагрегатний, що зумовлено пригніченням ЦОГ-1- опосередкованої продукції ТхА2 тромбоцитами. Цей ефект АСК широко використовують у клінічній практиці з метою первинної профілактики серцево-судинних і цереброваску- лярних порушень. У той самий час при збільшенні дози АСК (понад 300 мг/добу) селективність втрачається і спектр її фармакологічної дії збагачується за рахунок протизапального, знеболювального та жарознижувального ефектів, що дозволяє характеризувати АСК у відповідних дозах як типовий НПЗЗ [8, 34, 54].
Особливістю АСК є те, що вона чинить незворотну дію на ЦОГ-1 тромбоцитів за рахунок ацетилювання бічного радикалу серинового залишку в її активному центрі. При цьому тривалість антиагрегантної дії АСК зумовлена часом життя тромбоцитів, оскільки вони є без’ядерними клітинами і не здатні до синтезу білків de novo. Встановлено, що рівень ТхВ2, який є маркером синтезу ТхА2 тромбоцитами, у сироватці крові відновлюється після вживання АСК через 7-10 днів незалежно від дози препарату [21, 25, 48]. Це істотно відрізняє АСК від багатьох інших НПЗЗ, наприклад антиаг- реганий ефект індометацину забезпечується лише при збереженні терапевтично значущої концентрації лікарської речовини в крові [35].
У той самий час, інгібувальний ефект АСК на ЦОГ в інших тканинах (судини, шлунок, нирки) є короткочасним, що зумовлено їхньою здатністю до біосинтезу ферменту de novo. Вживання АСК у дозі 0,45 мг/кг на добу знижує у сироватці рівень ТхВ2 на 94-98%, у той час як вміст у сечі 6-ке- то-простагландина PGF1a, маркера активності позатромбо- цитарної ЦОГ і біосинтезу простацикліну PGI2 у нирках практично не змінюється [40].
Отже, спектр показань до застосування АСК істотно змінився протягом останніх 30 років. Якщо доцільність її широкого застосування в якості протизапального, знеболювального та жарознижувального засобу все частіше ставиться під сумнів, то застосування АСК у відповідних дозах в якості одного з ключових засобів профілактики тромбоген- них ускладнень і терапії ССЗ набуває всебічного обгрунтування [1, 4, 5, 8, 28].
Перші повідомлення щодо ефективності профілактичного застосування АСК в осіб з підвищеним ризиком ССЗ відносяться до середини ХХ ст. Так, L. Craven зазначав, що щоденне вживання АСК супроводжується зменшенням частоти виникнення ІМ, а також ризику розвитку порушень мозкового кровообігу [1, 28].
Виражені антиагрегантні і антитромботичні властивості низьких доз АСК зумовили її ефективне застосування для зниження ризику смерті внаслідок ІМ, транзиторних ішемічних атак (ТІА) та інсульту у пацієнтів з ТІА, захворюваності і смерті при стабільній і нестабільній стенокардії, а також для профілактики тромбозів та емболій після операцій на судинах (черезшкірна транслюмінальна катетерна ангіопластика, ендартеректомія сонної артерії, аортокоро- нарне шунтування, артеріовенозне шунтування), тромбозів глибоких вен і емболій легень після тривалої іммобілізації; ІМ у пацієнтів з високим або багатофакторним ризиком серцево-судинних ускладнень (цукровий діабет, контрольована артеріальна гіпертензія, гіперліпідемія, ожиріння, літній вік тощо) [1, 4, 5, 7, 8, 20, 22, 25, 34, 35, 38, 47, 48, 52].
Слід визнати, що висока профілактична ефективність застосування препаратів АСК відносно ризику розвитку фатальних проявів і тяжких ускладнень ССЗ переконливо доведена результатами численних клінічних досліджень, серед яких можна зазначити Cardiff-I, Cardiff-II, Paris-I, AMIS, CDP, GAMIS, ISIS-2, ISIS-3, APRICOT, SAPAT та ін. [23, 31, 36, 37, 42, 45].
У 2002 році Antithrombotic Trialists’ Collaboration опублікувало найбільший мета-аналіз рандомізованих клінічних досліджень з оцінювання ефективності та безпеки застосування АСК та інших антиагрегантів у пацієнтів з високим ризиком розвитку серцево-судинних ускладнень. У мета-аналіз були включені результати 287 досліджень, в яких брали участь 212 тис. пацієнтів з високим ризиком розвитку ускладнень, включаючи гострий коронарний синдром з підйомом та без підйому сегмента ST на ЕКГ, хронічну стабільну стенокардію, ішемічний інсульт, периферійний атеросклероз, а також артеріальну гіпертонію, цукровий діабет та інші серйозні фактори ризику розвитку ССЗ. Результати мета-аналізу свідчать про те, що призначення АСК дозволяє знизити ризик розвитку серйозних серцево-судинних ускладнень (нефатальний ІМ + нефатальний інсульт + смертність від ССЗ) на 22% [26].
Необхідно зазначити, що тривала монотерапія АСК хоча й продемонструвала свою високу ефективність, однак не позбавлена недоліків. Тривале пригнічення ЦОГ-1 супроводжується значним зменшенням тканинного рівня простагландинів, що виявляється, перш за все, різноманітними гастропатіями (включаючи виразкоутворення): інгібірування біосинтезу простагландинів у слизовій оболонці травного тракту (ТТ) призводить до порушення процесів мікроциркуляції, слизоутворення і регенерації. Уль- церогенні зміни під дією АСК розвиваються на тлі подовження часу кровотечі, яке зумовлено зменшенням продукції ТхА2, що підвищує ризик шлунково-кишкових кровотеч. Ця негативна дія в різному ступені характерна для усіх інгібіторів ЦОГ (в найменшому - для ЦОГ-2-селек- тивних) [29, 39, 46, 50].
Сьогодні на вітчизняному ринку представлено досить широке коло препаратів АСК, як монокомпонентних, так і комбінованих, що відрізняються дозою АСК, технологією виробництва, фармакокінетичними характеристиками, складом. Монопрепарати АСК для перорального застосування випускаються у формі звичайних жувальних і шипучих таблеток, а також таблеток, що вкриті кишковорозчинною оболонкою, із вмістом АСК від 50 до 500 мг [5, 8]. Така широка номенклатура торгових найменувань ставить лікаря-практи- ка перед нелегкою проблемою вибору. Слід зазначити, що ключовим критерієм вибору препарату є можливість забезпечення оптимального балансу його ефективності та безпечності лікування.
Оскільки антиагрегантні властивості та гастроток- сичність АСК пов’язані з одним й тим самим механізмом - пригніченням ЦОГ-1, основною стратегією, яка дозволяє забезпечити високу ефективність АСК щодо запобігання розвитку серцево-судинних подій і при цьому максимально знизити ризик можливих ускладнень, є застосування мінімальних доз. У 2012 році американська спілка торакальних терапевтів визнала доцільним призначення АСК з метою первинної профілактики ССЗ в осіб від 50 років у дозі 75-100 мг/добу (рівень доказовості 2В) [53].
Однак тривале застосування АСК навіть у низьких дозах може супроводжуватися негативними проявами з боку ТТ.
З метою вирішення цієї проблеми використовують два головні підходи. Сутність першого полягає у застосуванні
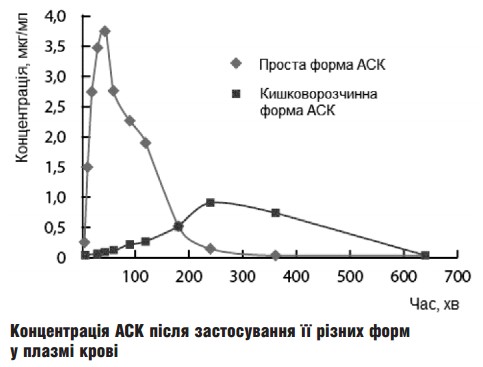
препаратів АСК у вигляді кишковорозчинних лікарських форм, які можливо чинять значно менш виражену гостро- токсичну дію. Але, по-перше: обмеження всмоктування АСК у ТТ супроводжується зменшенням її біодоступності і відповідно, зниженням вираженості терапевтичної дії. Відомо, що при вживанні АСК швидко абсорбується у проксимальному відділі тонкої кишки та у шлунку, при цьому частина АСК піддається деацетилюванню з утворенням неактивного саліцилату ще у слизовій оболонці ТТ. Таким чином, швидкість інактивації АСК у слизовій оболонці ТТ залежатиме від швидкості абсорбції, а вона, у свою чергу, від ступеня іонізації АСК (відомо, що найшвидше через біологічні мембрани проникають неіонізовані та малоіонізо- вані сполуки) [51].
При застосуванні простих форм АСК процес всмоктування починається ще у шлунку, де завдяки низькому рівню рН іонізація АСК пригнічена, бо за своїми властивостями вона є слабкою кислотою. При цьому концентрація АСК в плазмі досягає піку вже через 30-40 хв після вживання препарату [44].
На відміну від цього вивільнення АСК з препаратів, що мають кишковорозчинну оболонку, відбувається у проксимальному відділі тонкої кишки, де рівень рН значно вищий, ніж у шлунку, завдяки чому іонізація і інактивація АСК посилюються. Оскільки всмоктування кишковорозчинних форм сповільнене, то і концентрація АСК досягає піку лише через 3-4 год. Біодоступність АСК при використанні препаратів з кишковорозчинною оболонкою також зменшується. Так, K.A. Sagar та M.R. Smyth [49] встановили, що концентрація АСК у плазмі крові після застосування її простої форми досягає піку в 3 рази швидше порівняно з кишковороз- чинною формою (малюнок). Крім того, максимальна концентрація препарату була майже у 5 разів вище також після вживання простої АСК. Схожі дані наводять й інші дослідники [77].
З іншого боку, є всі підстави стверджувати, що при досягненні терапевтично значущої концентрації АСК у крові га- стротоксичність розвивається як системний ефект, який мало пов’язаний із негативним впливом на слизову оболонку препарату, що знаходиться у просвіті ТТ. Така точка зору підтверджується даними клінічних спостережень [2].
Таким чином, твердження щодо оптимального співвідношення терапевтичної ефективності та безпечності кишково- розчинних форм АСК не є однозначним. Зазначене не дозволяє розглядати ці препарати в якості остаточного засобу вирішення проблеми. Саме тому були розроблені комбіновані препарати, які окрім АСК містять у своєму складі компоненти, що виявляють антацидні властивості.
Одним із таких засобів є вітчизняний препарат Магнікор (виробництва ПАТ «Київський вітамінний завод»). Комбінований препарат Магнікор містить у своєму складі 75 мг АСК та 15,2 мг магнію гідроксиду.
В умовах порушення резистентності слизової оболонки ТТ, зумовленої дією АСК, магнію гідроксид, виявляючи антацидний ефект, обмежує вплив пептичних факторів, які діють у просвіті травного каналу на слизову оболонку, таким чином значно підвищуючи безпеку терапії [5, 8, 10, 14].
Раціональність такого підходу до профілактики НПЗЗ- зумовлених гастропатій підтверджується результатами досліджень. Так, було проведене вивчення впливу магнію гідроксиду, алюмінію гідроксиду і кальцію карбонату на біосинтез простагландинів в антральній і дуоденальній слизовій оболонці здорових добровольців [33]. Автори відзначали, що тривале застосування високих доз досліджуваних ан- тацидів, хоча і не виявлялося помітними змінами загального вмісту простагландинів у слизовій оболонці, але супроводжувалося змінами їхнього спектру, чого не фіксували на коротких термінах дослідження. Так, було встановлено, що на тлі 3-тижневого застосування досліджуваних засобів рівень PGE2 та PGF2a зростав, а вміст PGА2/В2, ТХА2 і проста- цикліну - зменшувався. Автори припускають, що у разі тривалого вживання антацидів механізм їхньої гостропротек- торної дії може включати зміну спектра простагландинів у гастродуоденальній слизовій оболонці.
Також було доведено, що на тлі застосування антацидів зменшується щільність антральных G-клітин і сироваткова концентрація гастрину [32].
Наведені дані про цитопротекторні властивості антацидних засобів роблять патогенетично обгрунтованим їхнє застосування з метою попередження негативного впливу на слизову оболонку ТТ різноманітних ульцерогенних агентів, у тому числі і НПЗЗ [11].
Що зумовило вибір саме магнію гідроксиду в якості ан- тациду під час розроблення складу препарату Магнікор та аналогічних засобів? По-перше, антацидний ефект магнію гідроксиду розвивається швидко і характеризується середньою тривалістю, він нейтралізує наявну в шлунку соляну кислоту і не впливає на її продукцію, що дуже важливо [12, 18]. По-друге, магнію гідроксид належить до антацидів, що не всмоктуються і, як наслідок, не викликають порушення кислотно-лужної рівноваги внутрішніх середовищ організму [9, 15, 18]. Крім того, антациди, що не всмоктуються, виявляють обволікальну дію, зв’язують лізолецитин і жовчні кислоти, що негативно впливають на слизову оболонку ТТ [11]. Магнію гідроксид також зменшує тиск у шлунку і 12-палій кишці, пригнічує м’язовий спазм і дуоденогастральный рефлюкс, скорочує час евакуації вмісту шлунка [8, 9, 14].
Наведені вище властивості магнію гідроксиду роблять його застосування ефективнішим і безпечнішим порівняно з багатьма іншими антацидами [4, 15].
Була клінічно доведена висока ефективність та безпечність комбінованих препаратів, що містять АСК і магнію гідрокарбонат, у порівнянні з монопрепаратами АСК (киш- коворозчинними і звичайними).
Так, російськими спеціалістами було проведено клінічне дослідження, що мало на меті порівняння ефективності і пе- реносимості комбінованого засобу (таблетки, що вкриті плівковою оболонкою, містять 75 мг АСК і 15,2 мг магнію гідроксиду), кишковорозчинної форми АСК (таблетки, що вкриті плівковою кишковорозчинною оболонкою, містять 100 мг АСК) і звичайних таблеток АСК у хворих на ІБС у тому числі і вагітних (до 35-го тижня). Результати спостережень свідчать, що усі досліджувані препарати АСК чинили інгібувальну дію відносно спонтанної та індукованої агрегації тромбоцитів, причому цей ефект виявився значнішим при використанні комбінації АСК + магнію гідрооксид та звичайної АСК і дещо меншим при лікуванні кишковороз- чинною формою. У той самий час, на тлі застосування комбінації АСК + магнію гідрооксид значно рідше, ніж при використанні інших форм АСК спостерігалися небажані явища з боку ТТ (у тому числі у вагітних) [2].
Подібних висновків дійшли й деякі інші дослідники [3].
ВИСНОВКИ
-
Аналіз даних наукової літератури стостовно фармакологічних властивостей ацетилсаліцилової кислоти (АСК) і магнію гідроксиду, що наведені в якості обґрунтування складу комбінованого препарату Магнікор, свідчить про ефективне поєднання вираженої антиагрегантної та гастропро текторної дії його компонентів.
-
Результати клінічних досліджень демонструють перевагу комбінованих препаратів, що містять АСК і магніюгідрооксид, за показниками ефективності та безпечності перед монопрепаратами АСК, як кишковорозчинними, так і звичайними.
-
Усе зазначене дозволяє зробити висновок про можливість широкого застосування препарату Магнікор в якості ефективного та безпечного засобу для профілактики та лікування різноманітних серцевосудинних захворювань, таких, як тромбоз, ішемічна хвороба серця, гострий коронарний синдром тощо.
СПИСОК ЛІТЕРАТУРИ
- Аспирин кардио в энтеросолю- бильной оболочке. Антитромбоцитар- ная терапия ацетилсалициловой кислотой / Под ред. М.Я. Руды. - Универсум Паблишинг, 1998. - 220 с.
- Баркаган З.С., Момот А.П., Котов- щикова Е.Ф., Шилова А.Н. Выбор препаратов и мониторинг эффективности антитромботических средств. Материалы научно-практической конференции «Острый коронарный синдром: проблемы патогенеза, профилактики, диагностики, классификации, терапии» 22-23 марта 2001. Томск; 2001. - С. 192-194.
- Безопасность и фармакоэкономическая эффективность применения различных препаратов ацетилсалициловой кислоты у пациентов с ИБС / Вїрткин А.Л., Аристархова О.Ю., Адо- нина Е.В. и соавт. // Русский медицинский журнал http://www.rmj.ru
- Державний формуляр лікарських засобів / Під редакцією В.Т. Чумака, В.І. Мальцева, А.М. Морозова, В.Д. Парія, А.В. Степаненко. Вип. 2. - К., 2010. - 845 с.
- Довідник лікарських засобів України 2010 / За ред. В.Т. Чумака // http://www.pharma- center.kiev.ua/view/dov
- Князева С.А., Мельник М.В., Шилов А.М. Антиагреганты в практике профилактики и лечения коронарных болезней сердца // http://www.rmj.ru
- Князева С.А., Шилов А.М. Ацетилсалициловая кислота - нестероидный противовоспалительный препарат как антиагрегант в практике лечения сердечно-сосудистых заболеваний // http://www.rmj.ru
- Компендиум 2009 - лекарственные препараты. В 2-х томах /Под ред. В.Н. Коваленко, А.П. Викторова - К..: Морион, 2009. - 2224 с.
- Конорев М.Р. Выбор оптимального антацидного препарата в клинической практике // Consilium Medicum. - 2003. - Т. 05, № 10. - Приложение Гастроэнтерология.- http://www.Consilium Medicum.htm
- Лагута П.С. Вопросы применения ацетилсалициловой кислоты в клинической практике: эффективность и безопасность // Русский медицинский журнал. - 2005. - Т. 13, № 19. - С. 1241-1245.
- Маалокс в лечении НПВП-ассо- циированных гастропатий / Катель- ницкая Л.И., Лужецкая И.В., Голиусо- ва С.А. и соавт. // Современные аспекты антацидной терапии. Маалокс в клинической практике / Под ред. О.Н. Минушкина. - М., 1998. - С. 51-53.
- Минушкин О.Н. Антацидные средства в лечении гастроэзофагеальной рефлюксной болезни // Фар- матека. - 2007. - № 6. - С. 44-47.
- Ольбинская Л.И., Гофман А.М. Лечение и профилактика тромбозов. - М.: Вагриус, 2000. - 196 с.
- Регистр лекарственных средств России. Энциклопедия лекарств. - М.: «РЛС-2008», 2007. - Вып. 16. - 1456 с.
- Современные аспекты антацид- ной терапии. Маалокс в клинической практике / Под ред. О.Н. Минушки- на. - М., 1998. - 59 с.
- Шварц Г.Я., Сюбаев Р.Д. Методические указания по изучению новых нестероидных противовоспалительных препаратов // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М., 2000. - С. 234-241.
- Эпидемиологические аспекты сердечнососудистых заболеваний http://medbe.rU/materials/obshchee/e pidemiologicheskie-aspekty-serdech- nososudistykh-zabolevaniy-/medbe.ru
- Antacids. Today’s drugs // Br. Med. J. - 1970. - Vol.3. - P.35-36.
- Aspirin ein Jahrhundertpharmakon - Leverkusen, 1983. - 84 s.
- Aspirin, sulfinpyrazone, or both in unstable angina: results of a Canadian multicenter trial / Cairns J.A., Gent M., Singer J. et al // N. Engl. J. Med. - 1985. - Vol. 313. - P. 1369-1375.
- Awtry E.H., Loscalzo J. Aspirin // Circulation. - 2000. - Vol. 101. - P. 1206-1218.
- Canner P.L. Aspirin in coronary heart disease. Comparison of six clinical trials // Israel J. Med. Sci. - 1983. - Vol. 19. - P. 413-423.
- Canner P.L. Aspirin in coronary heart disease. Comparison of six clinical trials // Israel J. Med. Sci. - 1983. - Vol. 19. - P. 413-423.
- Cipollone F., Rocca B., Patrono C. Cyclooxygenase-2 expression and inhibition in atherothrombosis // Arterioscler. Thromb. Vasc. Biol. - 2004. - Vol. 24. - P. 246-255.
- Clinical pharmacology of platelet cyclooxygenase inhibition / Patrono C., Ciabattoni G., Patrignani P. et al // Circulation. - 1985. - Vol. 72. - P. 1177-1184.
- Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. Antithrombotic Trialists’ Collaboration // BMJ. 2002. - Vol. 324. - P. 71-86.
- Cox D., Maree A.O., Dooley M. et al. Effect of enteric coating on antiplatelet activity of low-dose aspirin in healthy volunteers // Stroke. - 2006. - №37. - Р. 2153-2158
- Craven L.L. Acetylsalicylic acid, possibli prevention of coronary thrombosis // Ann. West. Med. Surg. - 1950. - Vol. 4. - P. 95-96.
- Dajani E.L., Agrawal N.M. Protective effects of prostaglandins against nonsteroidal anti-inflammatory drug-induced dastrointestinal mucosal injury // Int. J. Clin. Pharm. Res. - 1989. - Vol. 9, №6. - P. 359-369.
- Differential effects of two doses of aspirin on platelet-vessel wall interaction in vivo / Wu K.K., Chen Y.C., Fordham E. et al // J. Clin. Invest. - 1981. - Vol. 68, №2. - P.382-387.
- Double-blind trial of aspirin in primary prevention of myocardial infarction in patients with stable chronic angina pectoris / Juul-M^ler S., Edvardsson N., Jahnmatz B. et al [Swedish Angina Pectoris Aspirin Trial (SAPAT) Group] // Lancet. - 1992. - Vol. 340. - P. 1421-1425
- Effect of antacid and H2-receptor blocker treatment on gastric endocrine cells / Arnold R., Garbe I., Koop H. et al // Scand. J. Gastroenterol. Suppl. - 1984. - Vol. 101. - P.31-37.
- Effect of antacid treatment on endogenous prostaglandin synthesis in human antral and duodenal mucosa / Preclik G, Stange E.F., Gerber K. et al // Dig. Dis. Sci. - 1989. - Vol. 34 (12). - P. 1860-1864.
- Elwood P.C. Trial of acetylsalicylic acid in the secondary prevention of mortality from myocardial infarction // Br. Med. J. - 1981. - Vol. 282. - P. 481-483.
- Gafni Y., Schwartban M., Raz A. In vivo inhibition of PG biosynthesis by anti-inflammatory drugs: differential effects of aspirin, indomethacin and maclofenamic acid on PG-biosynthesis in rabbit and rat kidney. (Abstract) // Prostaglandins. - 1976. - Vol. 11, № 3. - P. 474.
- ISIS-2 Collaborative Group. Randomised trial of intravenous streptokinase, oral aspirin, both or neither among 17,187 cases of suspected acute myocardial infarction: ISIS-2 // Lancet. - 1988. - Vol. 2. - P. 349-360.
- ISIS-3 (Third International Study of Infarct Survival) Collaborative Group: ISIS-3: randomised comparison of streptokinase vs tissue plasminogen activator vs anistreplase and of aspirin plus heparin vs aspirin alone among 41299 cases of suspected acute myocardial infarction // Lancet. - 1992. - Vol. 339. - P. 753-770.
- Klimt C.R., Knatterud G.L., Stamler H. Persantin-aspirin reinfarction study. Part II: secondary prevention with persantin and aspirin // J. Am. Coll. Cardiol. - 1986. - Vol. 7. - P. 251-269.
- Kuwayama H., Matsyo Y., Eastwood G.L. Gastroduodenal mucosal injury by nonsteroidal anti-inflammatory drugs // Drug Invest. - 1990. - Vol. 2. - Suppl. №1. - P. 22-26.
- Low-dose aspirin in patients recov ering from myocardial infarction. Evidence for a selective inhibition of thromboxane-related platelet function / De Caterina R., Giannessi D., Bernini W. et al // Eur. Heart J. - 1985. - Vol. 6. - P. 409-417.
- Martindal. The Complete Drug Reference. - London: Pharmaceutical Press, 2009. - 3694 p.
- Meijer A., Werter C.J., Verheugt F.W.A. The APRICOT study: Coumadin versus aspirin in the prevention of reocclusion after successful thrombolysis, a prospective, placebocontrolled angiographic study // Circulation. - 1991. - Vol. 84, Suppl II. - P.571.
- Nietsch P. Therapeutic application of aspirin. - Germany, 1989. - 75 p.
- Patrono C., Coller B., Dalen J.E. et al. Platelet-active drugs: the relationships among dose, effectiveness, and side effects // Chest. 2001. - № 119. - Р. 39S-63S.
- Peto R. Aspirin after myocardial infarction // Lancet. - 1980. - P. 1172-1173.
- Rainsford K.D., Brune K. Selective cytotoxic actions of aspirin on parietal cells: a principal factor in the early stages of aspirin-induced gastric damage // Arch. Toxicol. - 1978. - Vol. 40. - P. 143-150.
- Randomised trial of prophylactic daily aspirin in British male doctors / Peto R., Gray R., Collins R. et al // Br. J. Med. - 1988. - Vol. 296. - P. 313-316.
- Roth G.J., Siok C.J. Acetylation of the NH2-terminal serine of prostaglandinsynthetase by aspirin // J. Biol. Chem. - 1978. - Vol. 253. - P. 3782-3784.
- Sagar K.A., Smyth M.R. A comparative bioavailability study of different aspirin formulations using on-line multidimensional chromatography // J. Pharm. Biomed. Anal. - 1999. - Vol. 21. - P.383-392.
- Selective inhibition of prostaglandin production in inflammatory exudates and gastric mucosa / Whittle B.J.R., Higgs G.A., Eakins C.E. et al // Nature. - 1980. - Vol. 280. - P. 271-273.
- Siel D., Griffin J., Andrews D.S. Plasma aspirin esterase activity: relationship to aspirin ingestion and peptic ulceration // Aust. N.Z.J.Med. - 1985. - Vol. 15. - P. 562.
- Steering Committee of the Physicians’ Health Study Research Group: Preliminary report: findings from the aspirin component of the ongoing physicians’ health study // N. Engl. J. Med. - 1989. - Vol. 321. - P. 129-135.
- Vandvik O, Lincoff AM. et al. Primary and secondary prevention of cardiovascular disease. Antithrombotic therapy and prevention of thrombosis, 9th ACCP Evidence - based Clinical Practice Guidelines. Chest, 2012; 141 (2):637s-668s.
- Vane J. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs // Nature. - 1971. - Vol. 231. - P. 232-253.






