
 Стаття
Стаття
 05.03.2025
05.03.2025
Выбор структурно-модифицирующих и противовоспалительных препаратов у пациентов с остеоартрозом
Н.М. Шуба, Т.Д. Воронова, А.С. Крылова Национальная медицинская академия последипломного образования им. П.Л. Шупика
Вибір структурно-модифікуючих та протизапальних препаратів у пацієнтів з остеоартрозом
Н.М. Шуба, Т.Д. Воронова, А.С. Крилова
На сьогодні встановлено нові механізми розвитку остеоартрозу (ОА), які обґрунтовують механізм дії та безпеку як протизапальних, так і структурно-модифікуючих препаратів. При лікуванні пацієнтів із гонартрозом препаратами вибору є хондроїтин сульфат-4 та -6, а також глюкоза мінсульфат, ефективність яких підтверджена у клінічних дослідженнях, при коксартрозі — діацереїн. Враховуючи ефективність застосування діацереїну і при гонартрозі, він є найбільш правильним вибором при лікуванні пацієнтів із поєднанням коксартрозу з гонартрозом. Діацереїн — ефективний засіб для зменшення вираженості болю і функціональних порушень, основних симптомів ОА, але оскільки він забезпечує ослаблення симптомів, починаючи з 2–4-го тижня лікування, необхідне його застосування з нестероїдними протизапальними препаратами у перші 2 тиж терапії, найкращим вибором серед яких можна вважати німесулід, враховуючи його не-ЦОГ-залежні ефекти.
Ключові слова: остеоартроз, протизапальний ефект, структурно-модифікуючий ефект, діацереїн, німесулід.
На сегодня установлены новые механизмы развития остеоартроза (ОА), которые обосновывают механизм действия и безопасность как противовоспалительных, так и структурно-модифицирующих препаратов. При лечении пациентов с гонартрозом препаратами выбора являются хондроитин сульфат-4 и -6, а также глюкозамин сульфат, эффективность которых подтверждена в клинических исследованиях, при коксартрозе — диацереин. Учитывая эффективность применения диацереина и при гонартрозе, он является наиболее правильным выбором при лечении пациентов с сочетанием коксартроза с гонартрозом. Диацереин — эффективное средство для уменьшения выраженности боли и функциональных нарушений, основных симптомов ОА, но поскольку он обеспечивает ослабление симптомов, начиная со 2–4-й недели лечения, необходимо его применение с нестероидными противовоспалительными препаратами в первые 2 нед терапии, наилучшим выбором среди которых можно считать нимесулид, учитывая его циклооксигеназазависимые эффекты.
Остеоартроз (ОА) — самое частое заболевание суставов во многих популяциях земного шара, которое обычно манифестирует у лиц старше 40 лет. В крупном эпидемиологическом исследовании в США выявили рентгенографические признаки ОА по крайней мере одной суставной группы у ⅓ взрослых в возрасте 25–75 лет, а распространенность его повышалась с возрастом. Так, среди лиц в возрасте 65 лет заболевание диагностировали в 50% случаев, а старше 75 лет — в 80%. По оценкам эпидемиологов установленный врачами диагноз ОА имеют более 20 млн взрослых в США. Диагноз ОА ранее обосновывали только рентгенологическими критериями. Частота боли в коленных суставах при налички рентгенологического ОА, по данным различных исследований, составляла от 40 до 80%, а повышение частоты боли наблюдалось у лиц в возрасте ≥50 лет (Zhang W. et al., 2010).
ОА — гетерогенная группа дегенеративных заболеваний суставов различной этиологии с подобными
биологическими, морфологическими и клиническими проявлениями и последствиями. К патологическим
проявлениям ОА относятся повреждения суставного хряща, поражения субхондральной кости, воспали-
тельные процессы в синовиальной оболочке, поражение связок и капсулы сустава, поражение мышц.
ОА — патология с довольно сложным патогенезом, с участием различных медиаторов, приводящих к иммунным нарушениям с развитием воспаления и деструкции хрящевой ткани.
С каждым годом расширяются представления о патогенезе ОА. На сегодняшний день при развитии ОА
большое значение имеют цитокины. Цитокины — низкомолекулярные белки (5–50 кДа), которые являются
химическими посредниками между клетками и участвуют в таких процессах, как рост и дифференцирование клетки, репарации тканей, ремодулировании и регулировании иммунного ответа, регулируют величину, характер и длительность воспалительного ответа при остром и хроническом воспалении.
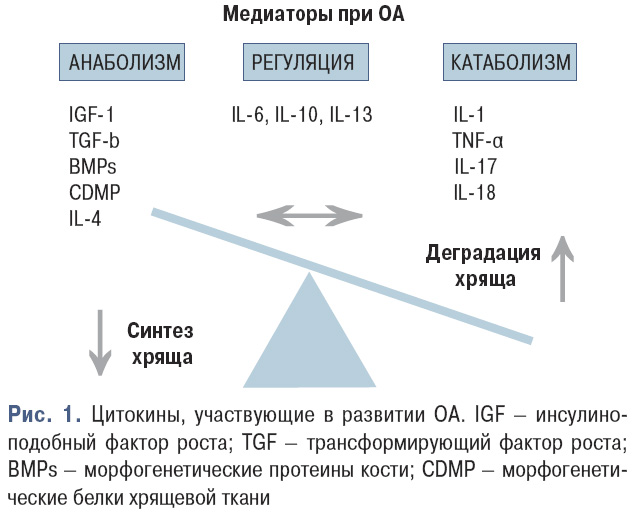
Некоторые цитокины обычно определяются в крови в течение воспалительного процесса (например фактор некроза опухоли (TNF)-α при РА). Другие определяются в крови не часто, а чаще в очаге поражения или непосредственно в микросреде (например интерлейкин (IL)-1). Цитокины, участвующие при развитии ОА, показаны на рис. 1.
Ключевым медиатором при ОА является IL-1. На рис. 2 показана роль IL-1 в патогенезе ОА.
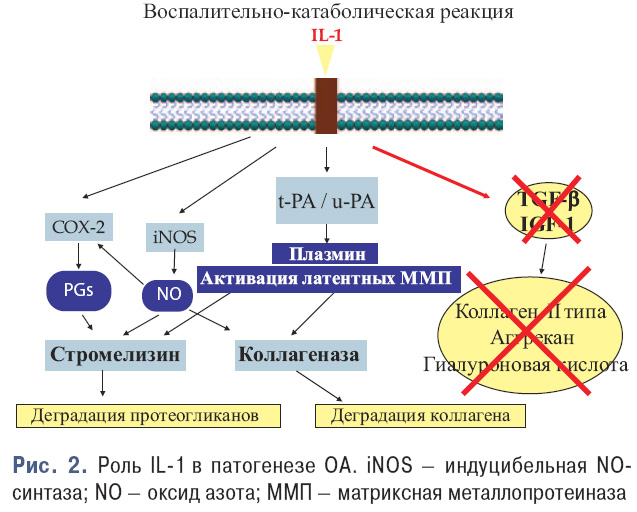
Таким образом, IL-1:
- Вызывает повреждение хряща посредством стимуляции продукции других цитокинов, матриксных металлопротеаз и NO.
- Вызывает воспалительный процесс при OA.
- Вызывает апоптоз хондроцитов.
- Активирует остеокласты в субхондральной кости, что является причиной изменения субхондральной кости.
- Стимулирует собственную продукцию, что обеспечивает постоянное повреждение хряща.
В последние годы показана также ведущая роль в патогенезе ОА супероксидных радикалов кислорода, iNOS, ядерного фактора каппа-би (NF-κβ). Роль супероксидных радикалов кислорода показана на рис. 3.
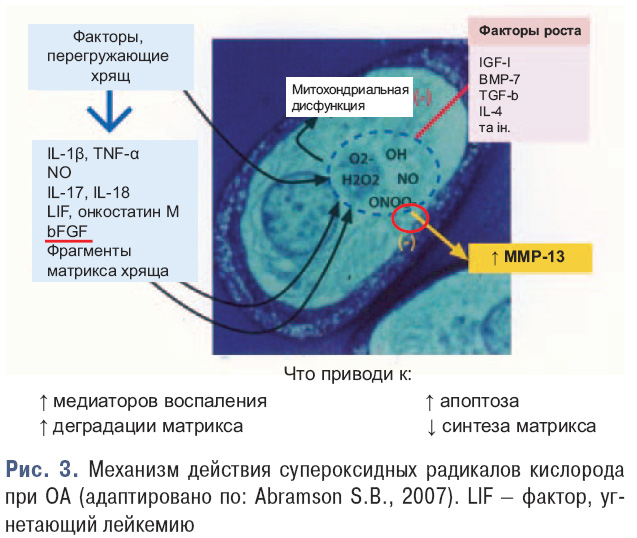
Кроме супероксидных радикалов кислорода, в патогенезе ОА значительная роль принадлежит идуцибельной NO-синтазе.
На сегодня известно три изоформы NO-синтазы:
- нейронная NO-синтаза (nNOS), которая осуществляет метаболические процессы в нервной ткани;
- эндотелиальная NO-синтаза (eNOS), которой принадлежит основная роль в вазодилатации;
- индуцибельная NO-синтаза (iNOS), которой присуща значительная роль в осуществлении фагоцитоза (рис. 4) и в воспалении.
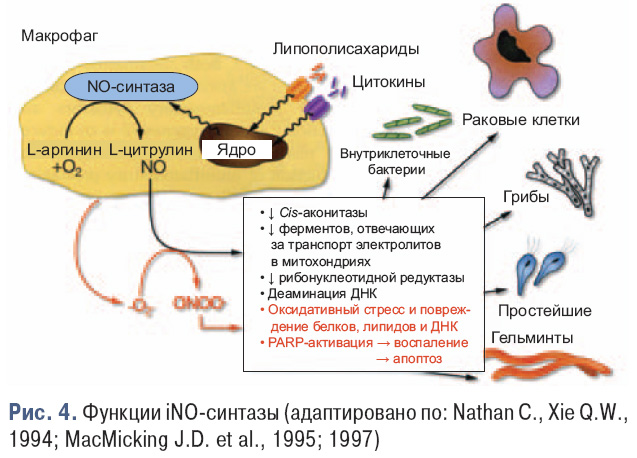
В последние годы установлена роль NO в патогенезе ОА (Lotz M., 1999; Abramson S.B. et al., 2001; Abramson S.B., Amin A., 2002; Fermor B. et al., 2007),
а именно:
1. iNOS через NO может приводить непосредственно к патологическим изменениям в суставах.
2. В хондроцитах iNOS индуцируется цитокинами, особенно IL-1β и TNF-α, стимулируя их соб-
ственную продукцию, что приводит к прогрессирующей деструкции суставного хряща.
3. Чрезмерная продукция NO в суставе подавляет матриксный синтез и вызывает его разрушение.
4. NO вызывает повреждения клеток вследствие образования пероксинитрита (ONOO–), а также апоптоз хондроцитов.
5. Применение ингибиторов NOS в экспериментальном артрите вызвало уменьшение воспаления синовии, деструкции хряща и кости.
Еще один важный фактор в патогенезе ОА — NFkB (рис. 5) — один из ведущих регуляторов процесса воспаления в различных тканях при различных патологиях. Он контролирует экспрессию генов воспаления, иммунного ответа и апоптоза. NF-kB содержится в цитоплазме в неактивной форме, а под действием IL-1β, TNF-α происходит активация супероксидных радикалов и транслокация NF-kB в ядро. NF-kB меняет транслокацию более 150 генов, вызывает воспаление, апоптоз и аутоиммунные заболевания.
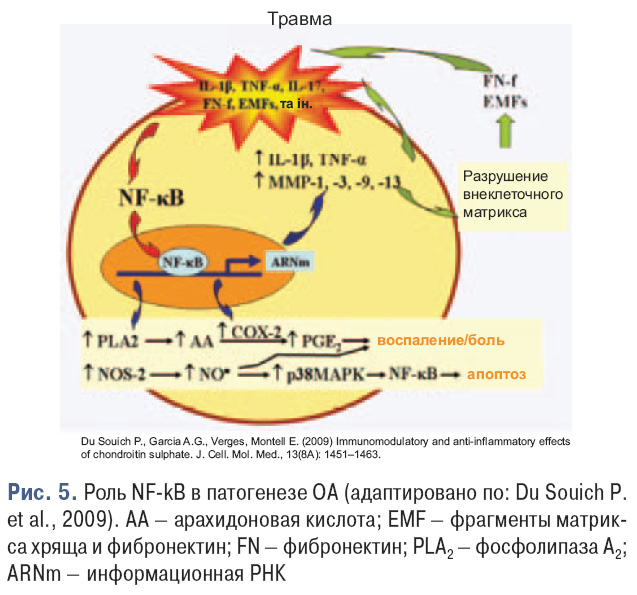
Лечение пациентов с ОА является сложной проблемой и базируется на современных данных о патогенезе этого заболевания. На современном этапе каждая схема лечения ОА должна включать наряду
с обезболивающими и/или нестероидными противовоспалительными препаратыми (НПВП) и структурно-модифицирующие препараты, поскольку положительное влияние последних на метаболизм внутрисуставных тканей, в первую очередь, на хрящ, и медленное симптоматическое действие не вызывают сомнения. На сегодня имеем доказательную базу для применения структурно-модифицирующих
препаратов в виде:
- рекомендаций Европейской антиревматической лиги (EULAR) 2003: доказательный поход по лечению остеоартрита коленных суставов (отчет специальной комиссии Постоянного комитета по международным клиническим исследованиям, включая терапевтические трайлы (ESCISIT)) (Jordan K.M. et al., 2003);
- рекомендаций Европейской антиревматической лиги (EULAR) 2005: доказательный подход к лечению остеоартрита тазобедренных суставов (отчет специальной комиссии Постоянного комитета по международным клиническим исследованием, включая терапевтические трайлы (ESCISIT)) (Zhang W. et al., 2005);
- рекомендации OARSI по менеджменту пациентов с коксартрозом и гонартрозом, 2010 г., (Zhang W. et al., 2010).
Предполагается, что эти препараты вызывают не только симптоматическое действие (уменьшение выраженности боли, улучшение функции суставов), их длительное применение способно замедлять прогрессирование ОА.
Зарегистрированными в Украине являются хон дроитин сульфат-4 и -6, глюкозамины (глюкозамин сульфат) и диацереин. Структурно-модифицирующие действие хондроитин сульфата подтверждено во многих исследованиях, а именно при гонартрозе за последние годы (Mishel B.A. et al., 2005; Hochberg M.C. et al., 2008; Kahan A. et al., 2009; Hochberg M.C. et al., 2010; Lee Y.H. et al., 2010; Wildi L.M. et al., 2011) и не подтверждено при коксартрозе (Reichenbach S. et al., 2007; Wandel S. et al., 2010). Структурно-модифицирующий эффект глюкозамин сульфата подтвержден в нескольких исследованиях при гонартрозе (Reginster J.Y. et al., 2001; Pavelka K. et al., 2002; Lee Y.H. et al., 2010) и не под. тверждено при коксартрозе (Wandel S. et al., 2010).
При лечении коксартроза с гонартрозом препаратом выбора является диацереин, структурно модифицирующее действие которого подтверждено в исследованиях для коксартроза (Dougados M. et al., 2001; Fidelix T.S. et al., 2006) и для гонартроза (Louthrenoo W. et. al., 2007; Pavelka K. et al., 2007; Zheng W.J. et al., 2006).
Диацереин представляет собой ацетилированную форму реина, его получают из реина путем этерификации, пероральный препарат для лечения пациентов с ОА, действующий как ингибитор образования IL-1 и его патологических эффектов.
При лечении больных ОА регуляция синтеза цитокинов и их активности, а также ингибирование свободных радикалов является центральным фактором для сохранения хряща и восстановления гомеостаза в суставе. Нейтрализация цитокинов и свободных радикалов на фоне стимуляции факторов роста хряща является перспективным подходом к процессу контроля за повреждением хряща при OA.
Диацереин обладает антикатаболическими и проанаболическими свойствами. В качестве антикатаболического эффекта он ингибирует: стимуляцию цитокинов, таких как IL-1 (Moldovan F. et al., 2000), IL-1-индуцируемый NO (Pelletier J.P. et al., 1998), различные свободные радикалы кислорода (Schцngen R.N. et al., 1988), продукцию MMPs (Pelletier J.P. et al., 1998), апоптоз хондроцитов (Pelletier J.P. et al., 2003) и стимулирует продукцию TIMPs (фактор ингибирования металлопротеаз) (Sanchez C. et al., 2003). Его проанаболические свойства включают стимуляцию факторов роста TGF-b и IGF (Felisaz N. et al., 1999), экстрацеллюлярные компоненты матрикса, такие как протеогликаны (Yaron M. et al., 1999), аггрекан (Sanchez C. et al., 2003) гиалуроновая кислота, коллаген II типа (Martin G. et al., 2003), даже в присутствии IL-1.
Кроме того, диацерин способен действовать и на воспаленную клетку, путем ингибирования IL-1, MIP-1B и свободнорадикальных продуктов в воспаленной клетке (Sanchez C. et al., 2003), продукции и фагоцитарной активности макрофагов и нейтрофилов, хемотаксиса лейкоцитов. Через ингибирование хемотаксиса и фагоцитоза уменьшается высвобождение цитокинов, свободных радикалов и протеолитических ферментов, что противодействует разрушению матрикса хряща.
Таким образом, можно выделить следующие механизмы действия диацереина — экстрацеллюлярное действие: уменьшается количество IL-1ra на поверхности клетки, посредством ингибирования активности IL-1 на IL-1ra (Yaron М. et al., 1999) и интрацеллюлярное (рис. 6): предупреждает активацию неактивного IL-1b через IL-1-конвертирующий фермент (ICE) (Moldovan F. et al., 2000), предупреждает AP-1-индуцированную MMP-продукцию через его влияние на NF-kβ (Mendes A.F. et al., 2002; Martin G. et al., 2003).
Пути внутриклеточной передачи изображенына рис. 6.
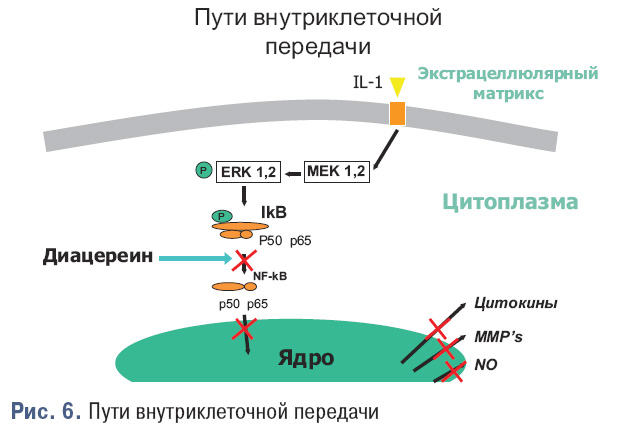
Как видно (см. рис. 6), диацереин предотвращает IL-1-индуцируемую экспрессию протеинов, участвующих в катаболических процессах, блокируя деградацию ингибиторного протеина IkB-α, и последующую активацию фактора транскрипции NF-kβ, а также его транслокацию к ядру.
Это является важным, поскольку экспрессия генного кодирования факторов воспаления, таких как IL-1, IL-6, TNF-α и MMPs, регулируется посредством NF-kβ активности. NF-kβ-активность также влияет на индукцию iNOS и синтез NO в хондроцитах, что играет очень важную роль (наряду с другими факторами) в апоптозе хондроцитов при ОА (Pelletier J.P. et al., 2000; Jovanovic D.V. et al., 2002).
Диацереин обладает и противовоспалительным действием, ингибируя IL-1, влияет на воспалительный каскад, обеспечивая ингибирование основных медиаторов, ответственных за распространение и обострение воспалительного процесса при ОА. В конечном итоге это приводит к снижению количества химических медиаторов, таких как простагландины ПГЕ2, ПГD2 и ПГF2, которые, как известно, повышают чувствительность ноцицепторов (болевых рецепторов). Это способствует уменьшению выраженности боли при ОА (рис. 7).
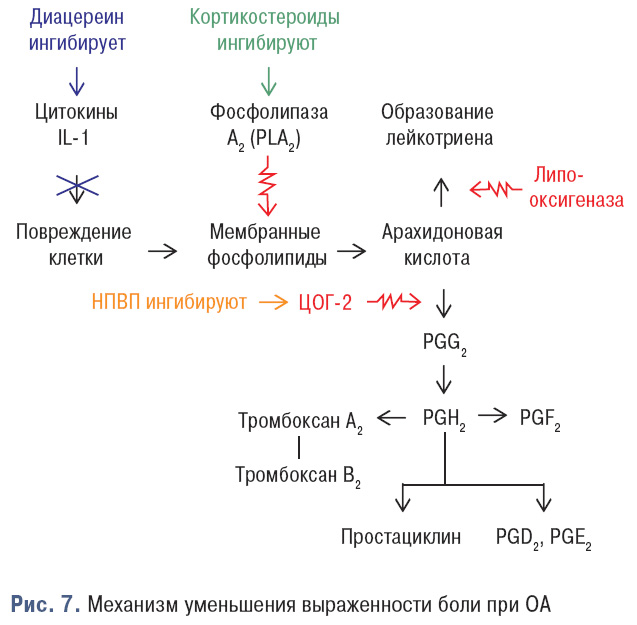
Но так как диацереин имеет замедленное начало действия, с симптоматическим улучшением через 2–4 нед лечения и клинически значимым отличием от плацебо — через 4–6 нед, первые 2 нед необходимо применение НПВП, препаратом выбора среди которых является нимесулид. Среди всех НПВП он обладает хондропротекторным действием, а поскольку ОА часто отмечается у лиц с сопутствующей кардиоваскулярной патологией, то такие свойства нимесулида, как активация синтеза ингибитора тканевого активатора плазминогена и блокирование синтеза тромбоцитактивирующего фактора, очень важны в предупреждении тромбоэмболических осложнений. Его не-ЦОГ-зависимые механизмы действия на хрящевую ткань: блокирование активности iNO-синтетазы, пероксинитрита (ONOO–), ингибицию IL-6, а также супероксидных радикалов кислорода, которые являются ключевыми медиаторами в деградации хряща и развитии воспалительного процесса, отмену апоптоза хондроцитов, блокирование коллагеназы и стромелизина, что приводит к уменьшению деградации коллагена II типа и протеогликанов (Rainford K.D., 2006).
На сегодняшний день проведено 31 клиническое исследование по изучению клинической эффективности и безопасности диацереина при лечении больных ОА, с участием >6000 пациентов. 7 исследований были плацебо-контролируемыми, 12 проводилось с активным контролем лекарства, 4 — плацебо-контролируемыми с активным контролем лекарства и 8 — неконтролируемыми.
Среди них представляют интерес два исследования, под руководством T.S. Fidelix (2006) и M. Dougados (2001). В рандомизированном многоцентровом двойном слепом плацебо-контролируемом исследовании ECHODIAH. M. Dougados и соавторы (2001) оценивали структурно-модифицирующее действие диацереина у пациентов с первичным коксартрозом (n=507). Рентгенографическая прогрессия не менее чем на 0,5 мм была значительно меньше и отмечалась позже в группе диацереина по сравнению с группой плацебо. Разница между группами становилась все больше во время исследования и стала существенной к концу 3-го года (ITT: 50,7% против 60,4 пациентов; р=0,036). В расширенной группе испытуемых разница между группами была более существенной, рентгенографическая прогрессия — 47,3% в группе диацереина по сравнению с 62,3% в плацебо-группе (р=0,007).
В исследовании T.S. Fidelix и соавторов 2006), включающих 2069 участников, показан последовательный, положительный эффект диацереина при лечении пациентов с ОА. По сравнению с плацебо боль по визуальной аналоговой шкале (0–100 мм) оценивали у 1228 участников, были получены статистически значимые различия в пользу диацереина –5,16 (95% доверительный интервал –9,75; –0,57). Также проанализирована рентгено-графическая прогрессия сужения суставной щели. При применении диацереина у пациентов с ОА тазобедренного сустава было статистически значимое замедление прогрессии.
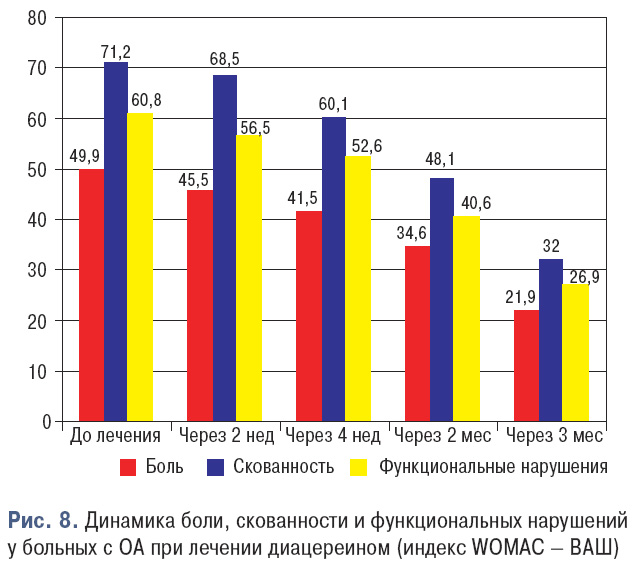
Учитывая вышеизложенное, на базе 1-го терапевтического отделения Клинической город ской больницы № 7 г. Киева проведено исследование по изучению применения диацерена при лечении больных с гонартрозом. В исследование было включено 152 пациента (123 женщины и 29 мужчин) с гонартрозом (II–III рентгенологическая стадия по Келгрен — Лоуренсу) в возрасте от 19 до 75 лет. Больные принимали диацереин в дозе 50 мг 2 раза в сутки в течение 3 мес. В начале лечения в святи с болевым синдромом был назначен НПВП — нимесулид (растворимая форма) в дозе 200 мг/сутне более 2 нед при отсутствии противопоказаний. Функциональное состояние больных оценивали по анкете Western Ontario and McMaster University osteoarthritis index (WOMAC).
В результате проведенного исследования при анализе показателей болевого синдрома и функционального состояния больных по анкете WOMAC (боль в покое и при нагрузке, скованность, ограничения в повседневной деятельности) отмечено достоверное снижение (р<0,05) всех показателей уже через 3 мес от начала исследования (рис. 8).
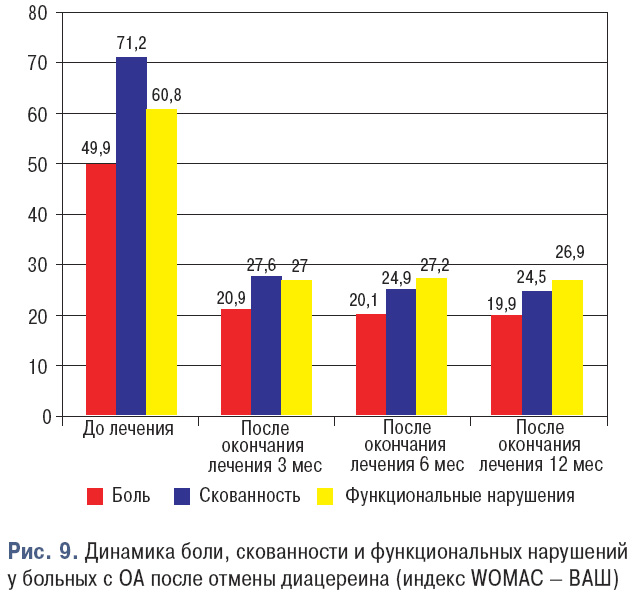
Кроме того, сохранялся терапевтический эффект и после отмены препарата (рис. 9).
Клинические исследования показали, что диацереин:
- обеспечивает ослабление симптомов, начиная с 2–4-й недели лечения, с клинически значимым отличием от плацебо спустя 4–6 нед;
- вызывает длительный эффект «последействия», что способствует сохранению терапевтического эффекта при отмене препарата;
- имеет сравнимую с НПВП эффективность и более длительный эффект «последействия» по сравнению с НПВП;
- обладает позитивным структурно-модифицирующим действием;
- безопасен и хорошо переносим по сравнению с НПВП, побочным эффектом чаще всего является диарея легкой, умеренной степени выраженности;
- обладает хорошей желудочно-кишечной переносимостью.
Таким образом, на сегодня установлены нове механизмы развития ОА, которые обосновывают механізм действия и безопасность как противно воспалительных, так и структурно-модифицирующих препаратов. При лечении пациентов с гонартрозом препаратами выбора являются хондроитин сульфат-4 и -6, а также глюкозамин сульфат, эффективность которых подтверждена в клинических исследованиях, при коксартрозе — диацереин. С учетом эффективности применения диацереина и при гонартрозе он является оптимальным выбором при лечении сочетания коксартроза с гонартрозом. Диацереин — эффективное средство для уменьшения выраженности боли и функциональных нарушений, основных симптомов ОА, но поскольку он обеспечивает ослабление симптомов, начиная со 2–4-й недели лечения, необходимо его применение с НПВП в первые 2 нед терапии, наилучшим выбором среди которых можно считать нимесулид, учитывая его не-ЦОГ-зависимые эффекты.
Список использованной литературы
Abramson S.B., Attur M., Amin A.R. et al. (2001) Nitric oxide and inflammatory mediators in the perpetuation of osteoarthritis. Curr. Rheumatol. Rep., 3: 535–541.
Abramson S.B., Amin A. (2002) Blocking the effects of IL-1 in rheumatoid arthritis protects bone and cartilage. Rheumatology (Oxford), 41: 972–980.
Abramson S.B. (2007) EULAR congress
Dougados M., Nguyen M., Berdah L. et al. (2001) Evaluation of the structure-modifying effects of diacerein in hip osteoarthritis: ECHODIAH, a three-year, placebo-controlled trial. Evaluation of the chondromodulating effect of diacerein in OA of the hip. Arthritis Rheum., 44: 2539–2547.
Du Souich P., Garcia A.G., Verges J. et al. (2009) Immunomodulatory and anti-inflammatory effects of chondroitin sulphate. J. Cell. Mol. Med., 13(8A): 1451–1463.
Fermor B., Christensen S.E., Youn I. et al. (2007) Oxygen, nitric oxide and articular cartilage. Eur. Cell. Mater., 13: 56–65; discussion 65.
Felisaz N., Boumediene K., Ghayor C. et al. (1999) Stimulating effect of Diacerein on TGF-Я1 and Я2 expression in articular chondrocytes cultured with and without IL-I.Osteo Cart, 7: 255–264.
Fidelix T.S., Soares B.G., Trevisani V.F. (2006) Diacerein for osteoarthritis. Cochrane Database Syst. Rev.: CD005117.
Hochberg M.C., Zhan M., Langenberg P. (2008) The rate of decline of joint space width in patients with osteoarthritis of the knee: a systematic review and meta-analysis of randomized placebo-controlled trials of chondroitin sulfate. Curr. Med. Res Opin., 29.
Hochberg M.C. (2010) Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta-analysis of randomized placebo-controlled trials of 2-year duration. Osteoarthritis Cartilage, 18(Suppl. 1): S28–31.
Jordan K.M., Arden N.K., Doherty M. et.al. (2003) EULAR Recommendation 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the StandingComm et al. ittee for International Clinical Studies Including Therapeutic Trials (ESCISIT) Ann. Rheum. Dis., 62: 1145–1155.
Jovanovic D.V., Mineau F., Notoya K. et.al. (2002) Nitric oxide induced cell death in human osteoarthritic synoviocytes is mediated by tyrosine kinase activation and hydrogen peroxide and/or superoxide formation. J. Rheumatol., 29(10): 2165–2175.
Kahan A., Uebelhart D., De Vathaire F. et al. (2009) Longterm effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial, Arthritis Rheum., 60: 524–533.
Lee Y.H. et al. (2010) Effect of glucosamine or chondroitin sulfate on the osteoarthritis progression: a meta-analysis. Rheumatol. Int., 30(3): 357–363.
Lotz M. (1999) The rate of nitric oxide in articular cartilage damage. Rheum. Dis. Clin. North Am., 25: 269–282.
Louthrenoo W., Nilganuwong S., Aksaranugraha S. et al. (2007) The efficacy, safety and carry-overeffect of diacerein in the treatment of painful kneeosteoarthritis: a randomised, double-blind, NSAIDcontrolled study, Osteoarthritis Cartilage, 15(6): 605 614.
MacMicking J.D., Nathan C., Horn G. et al. (1995) Altered responses to bacterial infection and endotoxic shock in mice lacking inducible nitric oxide synthase. Cell, 81: 641–650.
MacMicking J.D., North R.J., LaCourse R. et al. (1997) Identification of nitric oxide synthase as a protective locus against tuberculosis. Proc. Natl. Acad. Sci USA, 94: 5243–5248.
Martin G., Bogdanowicz P., Domagala F. et.al. (2003) Rhein inhibits interleukin-l beta-induced activation of MEK/ERK pathway and DNA binding of NF-kappa B and AP-I in chondrocytes cultured in hypoxia: a potential mechanism for its diseasemodifying effect in osteoarthritis. Inflammation, 27(4): 233–246.
Mendes A.F., Caramona M.M., de Carvalho A.P., Lopes M.C. (2002) Diacerhein and rhein prevent interleukin-1 beta-induced nuclear factor-kappaB activation by inhibiting the degradation of inhibitor kappaBalpha. Pharmacol Toxicol, 91: 22–28.
Michel B.A., Stucki G., Frey D. et al. (2005) Chondroitin 4 and 6 sulfate in osteoarthritis of the knee: A randomized, controlled trial. Arthritis Rheum., 52(3): 779–786.
Moldovan F., Pelletier J.P., Jolicoeur F.C. et.al. (2000) Diacerhein and rhein reduce the ICE-induced IL-ip and IL-18 activation in human osteoarthritic cartilage. Osteo Cart, 8: 186–196.
Nathan C., Xie Q.W. (1994) Nitric oxide synthases: roles, tolls, and controls. Cell, 78: 915–918.
Pavelka K., Gatterova J., Olejarova M. et al. (2002) Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch. Intern. Med.,162: 2113–2123.
Pavelka K., Trc T., Karpas K. et al. (2007) The efficacy and safety of diacerein in the treatment of painful osteoarthritis of the knee: A randomized, multicenter, double-blind,placebo-controlled study with primary end points at two months after the end of a three-month treatment period. Arthritis Rheum., 56(12): 4055–4064.
Pelletier J.P., Mineau F., Fernandes J.C. et.al. (1998) Diacerein and Rhein reduce the IL-1ra stimulated inducible nitric oxide synthesis level and activity while stimulating cyclooxygenase-2 synthesis in human osteoarthritic chondrocytes. J. Rheumatol., 25: 2417–2424.
Pelletier J.P., Jovanovic D.V., Lascau-Coman V. et al. (2000) Selective inhibition of inducible nitric oxide synthase reduces progression of experimental osteoarthritis in vivo: possible link with the reduction in chondrocyte apoptosis and caspase 3 level. Arthritis Rheum., 43(6): 1290–1299.
Pelletier J.P., Mineau F., Boileau C. et al. (2003) Diacerein reduces the level of cartilage chondrocyte DNA fragmentation and death in experimental dog osteoarthritic cartilage at the same time that it inhibits caspase-3 and inducible nitric oxide synthase. Clin. Exp. Rheumatol., 21(2): 171–177.
Rainsford K.D. (2006) Side-effects of anti-inflammatory analgesic drugs. Ann. Rheum. Dis., 66: 1211–1215.
Reichenbach S., Sterchi R., Scherer M. et al. (2007) Metaanalysis: chondroitin for osteoarthritis of the knee or hip. Ann. Intern. Med., 146: 580–590.
Reginster J.Y., Deroisy R., Rovati L.C. et al. (2001) Longterm effects of glucosamine sulphate on osteoarthritis progression: a andomised, placebo-controlled clinical trial. Lancet, 357: 251–256.
Sanchez C., Mathy-Hartert M., Deberg M.A. et al. (2003) Effects of rhein on human articular chondrocytes in alginate beads. Biochem Pharmacol., 65(3): 377–388.
Schцngen R.N., Giannetti B.M., van de Leur E. et al. (1988) Effect of diacetylrhein onthephagocytosis of polymorphonuclear leucocytes and its influence on the biosynthesis of hyaluronate in synovial cells. Arzneim-Forsch/Drug Res., 38(1): 744–748.
Yaron M., Shirazi I., Yaron I. (1999) Anti-interleukin-l effects of diacerein and rhein in human osteoarthritic synovial tissue and cartilage cultures. Osteoarthritis Cartilage, 7(3): 272–280.
Wildi L. et al. (2011) Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee OA patients starting as early as 6 months after initiation of therapy: a randomized, double-blind, placebo controlled pilot study using MRI. Ann. Rheum. Dis., 70: 982–989.
Wandel S. et al. (2010) Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. BMJ, 16: 341 (c4675. doi: 10.1136/bmj.c4675).
Zhang W., Nuki G., Moskowitz R.W. et al. (2010) OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009. Osteoarth. Cartil., 18(4): 476–499.
Zhang W., Doherty M., Arden N. et.al (2005) EULAR evidence based recommendations for the management of hip osteoarthritis: report of task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutic (ESCISIT) Ann. Rheum. Dis., 64: 669–681.
Zheng W.J., Tang F.L., Li J. et al. (2006) Efficacy and safety of diacerein in osteoarthritis of the knee: a randomized,multicenter, doubledummy, diclofenac-controlled trial in China, APLAR J. Rheumatology, 9(1): 64–69.
Стаття надана мовою оригіналу






