
 Стаття
Стаття
 26.02.2025
26.02.2025
Виром человека и его роль в формировании болезней. Герпетическая инфекция у детей: современные подходы к терапии
Г.В.Бекетова, Н.О. Савичук Национальная медицинская академия последипломного образования имени П.Л.Шупика
Резюме. В статье Бекетовой Г.В., Савичук Н.О., “Виром человека и его роль в формировании болезней. Герпетическая инфекция у детей: современные подходы к терапии” представлены данные, касающиеся вирусного компонента микробиома человека – вирома и его роли в поддержании здоровья и формировании болезней. 18% вирома человека cоставляют геспесвирусы. Среди них 8 являются возбудителями заболеваний человека. Обсуждены вопросы эпидемиологии, путей заражения, особенностей патогенеза и клиники герпетической инфекции у детей. Определена современная стратегия лечения гепесвирусных заболеваний. Обоснована целесообразность использования препарата двойного (противовирусного и иммуномодулирующего) действия Новирин, который содержит инозина пранобекс.
Ключевы слова: виром, дети, герпесвирусы, герпетическая инфекция, лечение, инозина пранобекс, Новирин
Вирусы являются наиболее распространёнными инфекционными агентами на Земле [3, 8, 18, 20]. Вирусный компонент микробиома называют виромом или ‘’вирусным метагеномом’’[13, 20]. Виром представляет собой совокупность всех вирусов, находящихся на слизистых оболочках (СО) и коже человека [26, 27]. С одной стороны–это вирусы, которые вызывают острую, постоянную или латентную инфекции, с другой стороны – интегрированые в геном человека. Виром включает в себя как эукариотические, так и прокариотические вирусы (бактериофаги) [9, 10, 21]. Доказано, что эукариотические вирусы оказывают значительное влияние на состояние здоровья человека. Они являются причиной острых самоограничивающихся или неконтролируемых, персистирующих и хронических инфекций, протекающих как с симптомами, так и бессимптомно (латентно). У каждого индивидуума свой уникальный виром с неповторимым набором штаммов вирусов (рис.1.) [10].
Виром – это часть организма человека и многие скрытые, бессимптомно живущие вирусы присутствуют в нём постоянно. При этом иммунная система (ИС) защищает организм от их патогенного воздействия. Вопреки распространенному мнению, патогенных вирусов значительно меньше, чем индигенных (полезных). При этом, наше понимание роли индигенных вирусов для поддержания здоровья человека находится в зачаточном состоянии [9, 10, 21].
В настоящее время всестороннее изучение всех классов микроорганизмов, в том числе и вирусов, присутствующих в различных биотопах человека, проводится в рамках международного проекта “Микробиом человека”, который финансируется Национальными институтами здравоохранения всех развитых стран мира [13]. Изучение вирома даст возможность определить роль его компонентов в поддержании здоровья и формировании болезней, особенно у детей и у пациентов с ослабленным иммунитетом, а также будет способствовать выявлению новых вирусов [17].

Современными методами секвенирования доказано, что среди вирусов, представляющих виром человека 18% занимают герпесвирусы (ГВ) (рис.2) [9, 11].
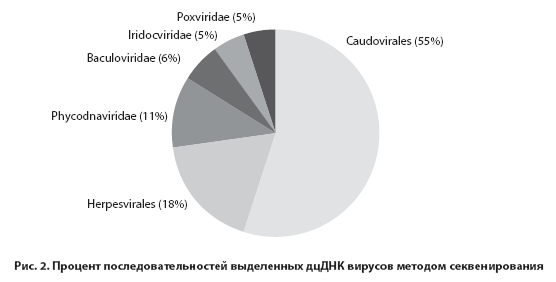
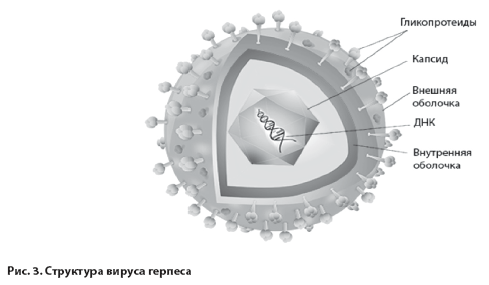
Герпесвирусы (лат. Herpesviridae) – большое семейство ДНК–содержащих вирусов, вызывающих разно- образные болезни, имеющие большое как медицинское, так и социальное значение. Они встречаются не только у человека и млекопитающих, но и у птиц, рептилий, амфибий и рыб. Название семейства происходит от греч. ἕρπειν (herpein) и латинского “herро”, что означает “ползаю”. Герпесвирус имеет диаметр 120-150 нм, состоит из капсида с гликопротеидами, внешней и внутренней оболочек (рис.3.), термолабилен, инактивируется при температуре 50-52°С через 30 минут, быстро разрушается под воздействием ультрафиолетового облучения, этилового спирта, органических растворителей, устойчив к низким температурам и высушиванию [11, 18].
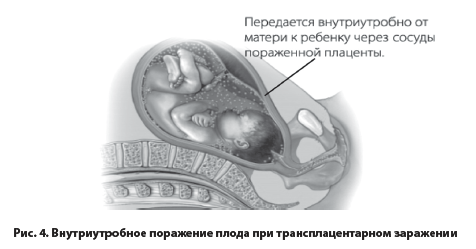
Эпидемиология герпетической инфекции (ГИ). По мнению экспертов ВОЗ в настоящее время в мире речь идёт о пандемии ГИ, поскольку ГВ заражено большинство взрослого и детского населения нашей планеты. К 5 годам жизни инфицированность ГВ составляет 60%, а в 15 лет–почти 90%. Высокая восприимчивость детей к ГИ обусловливается незрелостью их мукозального иммунитета (низкий уровень SIgA; слабо развиты герминативные центры в структурах лимфоглоточного кольца; несформированные лимфоэпителиальные узелки, незначительное количество макрофагов и плазматических клеток в СО, которые менее плотные, чем у взрослых и через них легко проникают различные антигены) [6, 7, 25]. Кроме того, в современных условиях кардинально меняются свойства ГВ, что обусловливает раннее начало ГИ, возникновение её новых клинических (часто и непрерывно рецидивирующих) форм, сложностей в диагностике, резистентности возбудителей к традиционным методам терапии. Доказана нейро-, эпителио-, гепато- и иммунотропность ГВ с высокой вероятностью формирования неопластических процессов при частом рецидивировании, тяжёлых поражений центральной и вегетативной нервной системы, особенно при внутри- утробном заражении плода (рис.4) [14, 19].
На сегодня известно около 200 видов вирусов семейства Herpesviridae, которые имеют особые механизмы взаимодействия с ИС хозяина. Вирусная ДНК экспрессирует определенные гены и, соответственно, кодируемые ими белки, которые и определяют жизненный цикл вируса в клетках хозяина, приводя к трансформации их фенотипических свойств. Трансформация клеток вызывает развитие иммунопатологических реакций, направленных против собственного организма с развитием вирусиндуцированной иммуносупрессии, что способствует персистенции ГВ у человека на протяжении всей его жизни. В клетках ГВ переходят в латентное состояние при котором нарушается их полный репродуктивный цикл и патогены находятся в них в виде субвирусных структур без клинических проявлений заболевания [6, 7, 8].
ГВ являются облигатным внутриклеточными агентами. При заражении человека ГВ адгезируются на клетках-мишенях, затем освобождаются от капсида и дополнительной оболочки-конверта, с последующим внедрением их ДНК в ядро клетки. Затем на ядерной мембране идет образование и созревание новых вирио- нов и их отпочковывание. Для построения оболочки ГВ, капсида и ДНК, используются аминокислоты, белки, липопротеиды и нуклеозиды клетки-хозяина. По мере истощения внутриклеточных резервов, эти молекулы поступают в инфицированную клетку из межтканевых пространств [6, 11, 16, 18, 25].
Семейство ГВ в соответствии с классификацией Международного комитета по таксономии вирусов (International Committee on Taxonomy of Viruses, ICTV) делится на 4 подсемейства:
- α-герпесвирусы (аlpha-herpesvirinae, VC 31.1.),
- β-герпесвирусы (beta-herpesvirinae, VC 31.2.),
- γ-герпесвирусы (gamma-herpesvirinae, VC 31.3.)
- подсемейство неклассифицируемых вирусов.
На сегодня известно 8 патогенных для человека типов ГВ, которые вызывают различные заболевания [8].
Классификация ГИ. При непродолжительной циркуляция ГВ в организме развиваются острая или инаппарантная (безсимптомная) формы; при длительной – латентная, хроническая (с рецидивами) или медленная формы. В зависимости от механизма заражения ГИ бывает врождённая и приобретенная: первичная, вторичная (рецидивирующая). Кроме того, выделяют типичные формы (поражение СО и пищеварительного тракта (ПТ) (стоматит, гингивит, фарингит), глаз (офтальмогерпескератит, конъюнктивит), кожи (герпес губ, лица, рук, ягодиц), гениталий, нервной системы (менингит, неврит, энцефалит), генерализованные: висцеральные (пневмонии, гепатит, эзофагит) и диссеминированные (сепсис), а также атипичные формы (отёчная, герпетиформная экзема Капоши, язвенно- некротическая, геморрагическая) [24].
В детском возрасте наибольшее клиническое значение имеют вирусы простого герпеса (ВПГ) (Herpessimplex), которые подразделяются на ВПГ I типа (Herpes labialis), поражающий CО глаз, ротовой полости, носа, красную кайму губ, кожу лица и т.п., а также ВПГ II типа (Herpes genitalis)–причина генитального герпеса. Клинически манифестная рецидивирующая форма ГИ, вызванной ВПГ, формируется у 15-25% инфицированных и диагностируется при наличии до 6 повторных эпизодов симптомов болезни в течение года. Часто рецидивирующая форма устанавливается при количестве рецидивов заболевания более 6 за год [15].
Особенностями герпетической инфекции, вызванной ВПГ является [24]:
1) пожизненная персистенция ВПГ в организме заразившегося, что указывает на отсутствие формирования стерильного иммунитета (т.е., противогерпетические антитела присутствуют, но возбудитель организм не покидает);
2) влияние ВПГ на ИС с формированием вторичного иммунодефицита, который с течением времени проявляется снижением сопротивляемости ребёнка к респираторным инфекциям, кожным возбудителям;
3) онкогенность ВПГ II типа – вероятность возникновения рака шейки матки при частых рецидивах заболевания;
4) тератогенность ВПГ ІІ типа и его способность вызывать спонтанные аборты и преждевременные роды, врожденную патологию новорожденных, нарушать их эмбрио- и органогенез;
5) формирование хронической формы болезни практически у всех пациентов, развитие частых рецидивов, что существенно нарушает качество жизни больных.
Особенности формирования иммунного ответа при ГИ, вызванной ВПГ [15].
Характерной особенностью иммунного ответа при ГИ является отсутствие полной элиминации возбудителя из организма человека в связи с низкой иммуногенность ВПГ и т.н. “особыми взаимоотношениями” вируса с ИС, которые протекают с включением нескольких фаз иммунной защиты:
1.Фаза раннего иммунного ответа (первые дни контакта ГВ и макроорганизма)–осущетвляется структурами моноцитарно-макрофагального звена, дендритными клетками, естественными киллерами (группа лимфоцитов, поверхность которых покрыта противогерпетическими антителами IgM и IgG, разрушающих свободно циркулирующие вирионы), копонентами системы комплемента. Результатом взаимодействия является массовая миграция клеток воспаления к очагу повреждения, синтез aльфа– и бета–интерферонов, способствующих формированию невосприимчивости клеток-мишеней к вирусу – с одной стороны, и уничтожение уже инфицированных клеток–с другой.
2.Фаза поздней защиты характеризуется тем, что макрофаги представляют герпесвирусы Т-, а также и В-лимфоцитам с последующей их трансформацией в антителообразующие плазматические клетки. Антитела связывают вирус, находящийся внеклеточно. В эту же фазу происходит синтез макрофагами и лимфоцитами провоспалительных медиаторов, что завершает защитную реакцию воспаления [24].
Типоспецифический иммунный ответ формируется за 14-28 дней после первичной встречи организма с ВПГ вне зависимости от формы заболевания (с типичными проявлениями или без симптомов). При полноценно сформированном стереотипе иммунного ответа на ВПГ с наличием достаточного пула высокоавидных длительно живущих противогерпетических IgG ГИ приобретает латентное течение. Реактивация ГИ без её клинически манифестных проявлений приводит к повторной наработке антител. В случае формирования неполноценного специфического (противогерпетического) иммунного ответа формируются клинически манифестная рецидивирующа, часто или непрерывно рецидивирующая формы ГИ, которые сопровождаются снижением функциональной активности и общего количества Т- и В-лимфоцитов, изменениями в системе интерферонов, макрофагальном клеточном звене [18].
Источником заражения ВПГ является больной различными формами заболевания (в т.ч. латентными) или вирусоноситель. Передача инфекции осуществляется контактным, воздушно-капельным, трансплацентарным и трансфузионным путями [25].
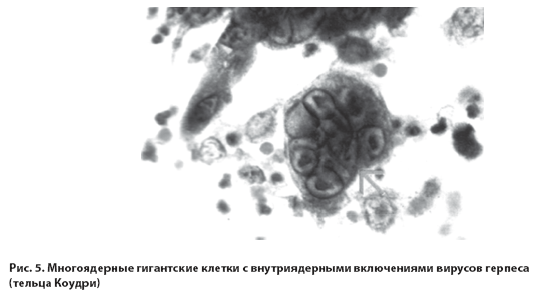
Патогенез ГИ. ГВ адгезируются и проникают в клетки СО и кожи (инкубационный период 6-12 дней). Размножение вирусов в эпителиоцитах сопровождается гиперемией СО или кожи, возникновением везикул, затем эрозий (обусловлено цитолитической активностью возбудителя), формированием многоядерных гигантских клеток Цанка с внутриядерным включением ГВ (тельца Коудри) (рис.5) [15, 24, 25, 26, 27].
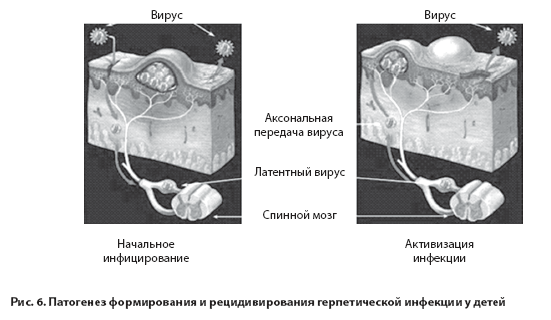
ГВ распространяются гематогенно, лимфогенно и неврогенно с поражением лимфоидных структур, печени, селезёнки. Через несколько дней из места локального поражения ГВ по сенсорным нейронам проникают в чувствительные ганглии, где затем длительно персистируют в латентной форме. Обострение ГИ происходит под воздействием физических факторов (инфекция, переохлаждение, гиперинсоляция) или психологического стресса, когда ГВ по нейронам достигают клеток-мишеней с формированием клинически мпнифестного рецидива (рис.6.) [14].
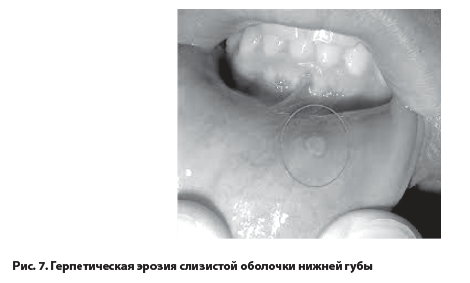
Клинические признаки ГИ. Заболевание, вызванное ВПГ, обычно протекает бессимптомно, но у детей часто бывает лихорадка, увеличение лимфатических узлов, везикулярный гингивит и стоматит (рис. 7), а у взрослых – фарингит и тонзиллит [15, 24].
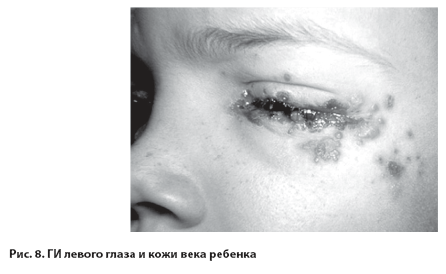
Иногда возникают первичные тяжёлые керато- конъюнктивиты с рубцовыми изменениями роговицы при частом рецидивировании ГИ (рис.8.).
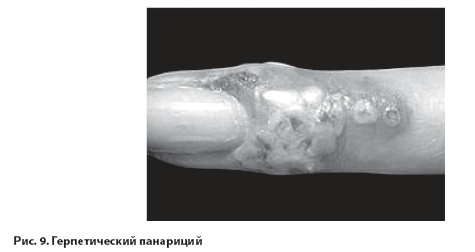
Первичные кожные заболевания (герпетический панариций) (рис. 9) возникают при повреждении кожного покрова (обычно на пальцах).
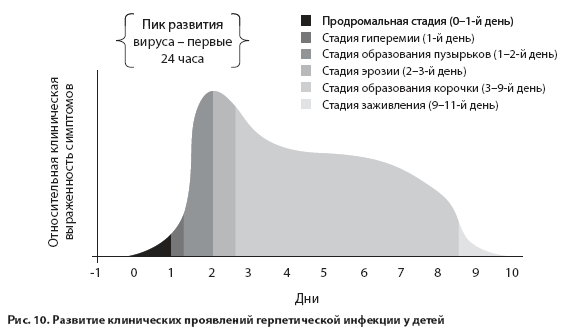
Этапы формирования клинических проявлений ГИ представлены на рис. 10.
ГВ входят в т.н. TORCH-комплекс и передаются от матери к ребенку во время беременности и родов, являясь причиной возникновения врождённых уродств, локальных форм ГИ (45%), а также генерализованного герпеса (25%), герпетических энцефалитов и менингоэнцефалитов новорождённых (35%) [8, 14].
ВПГ вызывает различные по степени тяжести клинические проявления – от легкой до угрожающей жизни. Оролабиальный и генитальный герпес являются распространенными поражениями, которые чаще всего лечат в амбулаторных условиях, однако, некоторые пациенты требуют неотложной помощи, по-этому, врачи должны быть осведомлены о возможных осложнениях ГИ [7, 8, 11, 15].
На заметку практическому врачу! “Минорность” клинических проявлений заболевания, которые ассоциируются преимущественно с Herpes labialis, Herpes nasalis, дерматитом, вводит в заблуждение клиницистов, препятствует формированию реального видения распространенности патологического процесса. Это обуславливает и “локальный” подход к лечению пациента, что в большинстве случаев не позволяет даже облегчить течение инфекции [14, 15].
Характер течения ГИ, частота и тяжесть рецидивов, в значительной степени, определяется состоянием ИС. Формирование адекватного иммунного ответа на антигены ГВ зависит от генетически детерминированных особенностей реагирования ребёнка, степени физиологической зрелости его общего и местного иммунитета и иммунного ответа в целом, выраженности транзиторного иммунодефицита на фоне рекуррентных респираторных заболеваний, детских инфекций, вакцинаций, которые предшествовали острой форме заболевания [24].
Среди острых форм ГИ у детей ведущее место занимают поражения верхних отделов ПТ, в частности, полости рта (стоматит), губ (хейлит) и кожи челюстно-лицевой области (ЧЛО) (дерматит) (рис.11.). Особое беспокойство специалистов вызывает значительное (в 5–6 раз) увеличение вероятности возникновения часто рецидивирующей формы ГИ кожи ЧЛО, которое наблюдается в последнее десятилетия во всем мире [7].
.png)
На сегодня риск рецидивирования герпетического стоматита и Herpes labialis есть у каждого второго ребенка, перенесшего острую форму заболевания.
Первичная (острая) форма герпеса у большинства детей возникает в возрасте от 6 месяцев до 3 лет. Подавляющее большинство детей в возрасте 3 лет имеют в сыворотке крови высокий титр специфических IgG антител к ВПГ, что свидетельствует об их раннем контакте с антигенами возбудителя [22].
Особенностью течения ГИ в настоящее время есть также высокий уровень формирования ассоциаций ВГ с другими, тропными к СО ПТ возбудителями (в частности, грибами рода Candida, Helicobacter pylori (Н.р.) с возрастанием частоты деструктивных и распространенных форм поражений гастродуоденальной зоны [1, 5, 12]. Такие поражения отличаются более тяжёлым клиническим течением, частыми рецидивами, длительным сроком эпителизации деструктивных дефектов [23], резистентностью к общепринятой терапии, формированием в дальнейшем язв желудка и двенадцатиперстной кишки, протекающих с выраженным болевым абдоминальным синдромом, развитием тяжелых осложнений (кровотечений, перфорации) [2] с дальнейшей инвалидизацией больных. Последнее обусловливает и социально-медицинские, и экономические аспекты проблемы.
Следует отметить, что рецидивирующий герпес (РГ) чаще всего протекает на фоне дисфункций и хронических заболеваний у ребёнка. Характер сопутствующих заболеваний и степень их активности в значительной степени обусловливают частоту обострений ГИ. У подав- ляющего большинства детей (96%) с РГ выявляют хронические заболевания ЛОР-органов. У каждого третьего пациента произведены оперативные вмешательства на регионарных иммунокомпетентных органах (адено-, тонзилл-, аппендэктомии) [6].
Таким образом, РГ у детей сопровождается [22, 24]:
1) персистированием ГВ в сенсорных ганглиях на регионарной стадии ГИ с формированием дермоневрального развития патологического процесса;
2) периодические рецидивы диссеминации ГВ с колонизацией регионарных нервных ганглиев;
3) формирование иммунодефицита в части нарушения функций, которые обеспечивают защиту СО и кожи с истощением (супрессией) неспецифических и специфических иммунных реакций;
4) патологическая колонизация СО и кожи возбудителями других оппортунистических инфекций грибковой, бактериальной и вирусной природы с формированием ассоциированных типов заболеваний;
5) наличие нарушений обмена веществ, дисфункций и хронических заболеваний;
6) дизрегуляция главных механизмов гомеостаза, прежде всего нейро-иммунно-эндокринных, с риском генерализации заболевания.
Вышеуказанное определяет тактику лечения больных с рецидивирующими и часто рецидивирующими формами герпеса с использованием современных подходов к контролю за рецидивами ГИ направленными на:
1) супрессию ГВ на разных этапах его репродукции с ослаблением (“истощением”) популяции вируса и последующей его элиминацией из регионарных нервных ганглиев;
2) формирование адекватного стереотипа иммунного ответа на ГВ с восстановлением барьерных функций СО и кожи, а также созданием условий для физиологического развития (“созревания”) местного и общего иммунитета у ребенка;
3) ограничение антигенного (экзо- и эндогенного) стимулирования для уменьшения нагрузки на ИС ребенка, в т.ч. инфекционного, аллергического;
4) коррекция нарушения обмена веществ, дисфункций, лечение хронических заболеваний [12, 22].
Вполне понятно, что реализация указанной тактики лечения детей с РГ возможна только при объединении усилий врачей различных специальностей – педиатров, инфекционистов, иммунологов, стоматологов, гастроэнтерологов, эндокринологов, оториноларингологов и других, а также при наличии специальных средств современной лабораторной и функциональной диагностики. Реализация такого взаимодействия возможна только в условиях специализированного звена оказания медицинской помощи детям.
Согласно представлениям о патогенезе РГ и механизмом действия современных противовирусных средств, лечение следует начинать в период обострения инфекции. Заданиями лечения можно считать:
1) активное воздействие на ВПГ на этапах его репликации для предупреждения “подсыпания” элементов поражения с максимальным уменьшением вероятности формирования жизнеспособных вирионов;
2) уменьшение риска вторичного инфицирования елементов поражения и пердупреждение ухудшения состояния колонизационной резистентности;
3) уменьшение признаков интоксикации;
4) ускорение эпителизации элементов поражения;
5) предупрждение рецидивирования ГИ [12, 22].
Для лечения ГИ у детей целесообразно использовать супресивные противогерпетические препараты, которые должны проникать в клетку, обладать минимальной цитотоксичностью, действовать избирательно на ГВ, не вызывать привыкания, не накапливаться в организме. На сегодня “золотым стандартом” является ацикловир в таблетках в возрастных дозах и 2,5-5% мази ацикловира в течение всего периода обострения (7-14 дней). Для предупреждения рецидивирования ГИ используют поддерживающие дозы ацикловира (1 таблетка 1 раз в сутки в течение 2-12 месяцев) [12].
В случае неэффективности ацикловира в результате его нерационального использования при предыдущих рецидивах ГИ, резистентности ГВ или тяжёлых и часто рецидивирующих формах заболевания, а также учитывая особенности формирования иммунного ответа при ГИ, наиболее целесообразно применять препараты двойного (противовирусного и иммуномодулирующего) действия, позволяющие восстановить стереотип иммунного ответа на антигены ГВ. К таким препаратам относятся средства, содержащие синтетический аналог метаболита пурина инозин со вспомогательным компонентом пранобекс, который увеличивает тропность инозина к лимфоцитам, обеспечивая противовирусное и иммуномодулирующее действие [4]. Инозин пранобекс показал высокую эффективность в терапии ГИ, вызванной ВПГ І и ІІ типа, что было сопоставимо с ацикловиром, и достоверно уменьшило число рецидивов заболевания в период наблюдения (http://www.ncbi.nlm.nih.gov/pubmed/25819042).
В настоящее время во многих странах СНГ широко используется препарат НОВИРИН (“Киевский витаминный завод” (Украина), который содержит высококчественную субстанцию инозина пранобекса. Препарат относится к средствам с широким прямым противовирусным действием в отношении ДНК- и РНК-содержащих вирусов (простого герпеса I, II, III типов, цитомегаловирусов и вирусов Эбштей-Барр, а также вирусов гриппа А и В, парагриппа, адено-, рино-, папиломавирусов). При этом, Новирин также оказывает выраженное влияние на факторы врождённого и приобретенного иммунитета. Препарат активирует функциональную активность натуральных киллеров, макрофагов и моноцитов, усиливает их хемотаксис, повышает продукцию эндогенных цитокинов (интерферонов и интерлейкинов), тем самым обеспечивая быстрый лечебный эффект при ГИ. Благодаря стимуляции синтеза интерферонов, Новирин также оказывает и опосредованный противовирусный эффект. Кроме того, он стимулирует дифференцировку пре-Т-лимфоцитов в цитотоксические Т-клетки и Т-хелперы (нормализуя соотношение Т-хелперов и Т-супрессоров). Препарат усиливает дифференцировку В-лимфоцитов в плазматические клетки с повышением синтеза противогерпетических антител (иммуноглобулинов А, М, G), а также поверхностных маркеров комплемента, что обеспечивает профилактический эффект с восстановлением нормального стереотипа иммунного ответа на антигены ГВ и, соответственно, контролем за рецидивами ГИ.
Важными эффектами Новирина есть противовоспалительная активность (снижение уровня экспрессии NF-kB лимфоцитов и ингибирование синтеза провоспалительных цитокинов), а также антиоксидантное действие (тормозит продукцию супероксида стимулированными нейтрофилами).
Новирин имеет высокую биодоступность, при приёме внутрь быстро абсорбируется и его пиковые концентрации в плазме отмечаются спустя 60 минут. Терапевтический эффект развивается через 30 минут и продолжается до 6 часов. Метаболизм инозина проходит по циклу, характерному для пуриновых нуклеозидов. Средсво полностью выводится из организма в неизменённом виде и в форме производных в течение 48 часов, не кумулируясь в организме.
Препарат принимают после еды с небольшим количеством воды. Используют у детей с 1 года жизни при наличии клинически манифестных проявлений ГИ из расчёта 50 мг/кг массы/сутки в 3-4 приёма 10–14 дней, с последующей поддерживающей терапией в период ремиссии в дозе 15 мг/кг 1 раз в сутки до 6 месяцев, или проводят 3 курса лечения по 8 дней в дозе 50 мг/кг/сутки в 3–4 приёма с двумя перерывами по 8 дней.
Новирин хорошо переносится пациентами, в т.ч. и при продолжительном применении. Побочным эффектом может быть кратковременное повышение количества мочевой кислоты в плазме и моче, что обусловлено спецификой метаболизма активного компонента препарата. Новирин противопоказан при индивидуальной непереносимости его компонентов, тяжёлых проявлениях подагры, почечной недостаточности III степени.
Важным моментом в терапии острой ГИ является уменьшение выраженности интоксикации, которая достигается употреблением достаточного количества жидкости в соответствии с возрастной потербностью и назначением сорбентов. Профилактика вторичной мик- робной инфекции достигается путем регулярной (3-5 раз в день) гигиенической обработки СО полости рта и зубов растворами антисептиков (0,1% раствор этония, раствор ектерицида, ротокан т.д.).
Для восстановления колонизационной резистентности СО верхних отделов ПТ в состав комплексной терапии включают иммуномодуляторы бактериального происхождения (мукозальные вакцины) с учётом индивидуальных особенностей микробиоценоза ротовой полости ребёнка. Для активизации неспецифических и специфических компонентов системы колонизационной резистентности, целесообразно осуществить 3 курса лечения по 10 дней с перерывом в 20 дней [3].
Обязательной составляющей реабилитации детей с РГ является длительное (2-3 года) диспансерное наблюдение с возможным устранением неблагоприятного воздействия факторов риска рецидива инфекции в тесном взаимодействии со специалистами разных профилей и родителями пациента [12, 15, 24].
Таким образом, лечение и профилактика рецидивирующих, часто и непрерывно рецидивирующих форм ГИ у детей являются сложной задачей. Одним из перспективных и современных подходов в ее решении является использование препаратов с двойным (иммуномодулирующим и противовирусным) действием, содержащих инозина пранобекс. К таким средствам, имеющим высокую эффективность, доказанную безопасность и хорошую переносимость, относится препарат Новирин.
Список литературы
- Бекетова Г.В. Етапне комбіноване лікування хронічних гастродуоденітів у дітей з хелікобактерно-герпетичним інфікуванням. //Збірник наукових праць співробітників КМАПО ім. П.Л.Шупика.-2002.-вип. 11.-кн.3.-С.658-665.
- Виноградова М.А. и соавт. Особенности течения язвенной болезни при наличии хеликобактериоза и герпетической инфекции. //Рос. журнал гастроэнтерол., гепатологии и колопроктол. – 1998. –№12. – С.21-24.
- Інфекційні хвороби (ред. О. А. Голубовської).–Київ:«Медицина».-2012.-С.778.
- Крамарёв С.А. Инозин пранобекс в практике врача-педиатра. //Педиатрия. Восточная Европа.- 2014.-№1(5).-С.70-76.
- Римарчук Г.В., /Комликова О.С. и др. Особенности течения хронического гастродуоденита, ассоциированные с вирусом простого герпеса первого типа у детей. // Рос. журнал гастроэтерол., гепатол. и колопроктол.-1997.-№5.-с.202-5.
- Чернишова Л.И. Особенности течения и лечения герпетической инфекции у детей. //Здоров’я України.-2015.-http://health-ua.com/article/838.html
- Akhtar J, Shukla D (2009). “Viral entry mechanisms: Cellular and viral mediators of herpes simplex virus entry”. FEBS Journal/-2009/-276 (24).-pp. 7228–7236.
- Alter S.J., Bennett J.S., Koranyi K., Kreppel A., Simon R. Common childhood viral infections. //Curr. Probl. Pediatr. Adolesc. Health Care.-2015.-45(2).-рр.21-53.
- Dalke, Kate. “The Human Virome”. Genome News Network. Retrieved 2 April 2013
- Delwart E.; Racaniello V. A Roadmap to the Human Virome. PLoS. //Pathogens.-2013.- 9 (2): e1003146.doi:10.1371/journal.ppat.1003146.
- Dreyfus D.H. Herpesviruses and the microbiome. //J. Allergy Clin. Immunol.- 2013.-№132(6).-Р.1278-1286.
- Gorovoj L., Beketova G.V., Senyuk O., Savichuk N., Savichuk A., Alexeenko N., Senyuk K., Bulgakova І. Treatment of Helicobacter, Herpes and candida infections of the digestive tract. //Chitosan in pharmacy and chemistry.-Italy.-2002.-p.151-155.
- ”Human Microbiome Project”. National Institutes of Health. Retrieved 30 May 2013
- James SH, Kimberlin DW. Neonatal Herpes Simplex Virus Infection. //Infect. Dis. Clin. North. Am.- 2015.-№29(3).-Р.391-400.
- Kolb A.W., Ané C., Brandt C.R. Using HSV-1 genome phylogenetics to track past human migrations. // PLoS One.-2013.- 8(10)/-e76267.
- Lipkin W. I. and Firth C. (2013) Viral surveillance and discovery. //Curr. Opin. Virol.-2013.-№3.-Р.199-204.
- Moon C. and Stappenbeck T. S. Viral interactions with the host and microbiota in the intestine. //Curr. Opin. Immunol.-2012.-№24.-Р.405-410.
- Pennisi E. Going Viral: Exploring the Role Of Viruses in Our Bodies. //Science.-2011.-№331(6024).-Р.1513–1513.
- Pichler M., Staffler A., Bonometti N., Messner H., Deluca J., Thuile T., Kluge R., Schmuth M., Eisendle K. Premature newborns with fatal intrauterine herpes simplex virus-1 infection: first report of twins and review of the literature. //J. Eur. Acad. Dermatol. Venereol.-2015.-№29(6).-Р.1216-1220.
- Rho M., Wu Y. W., Tang H., Doak T. G. and Ye Y. Diverse CRISPRs evolving in human microbiomes. //PLoS Genet.-2012.-№8: e1002441
- Rooks D.J., Smith D.L., McDonald J.E., Woodward M.J., McCarthy A.J., Allison H.E. 454-Pyrosequencing: A Molecular Battiscope for Freshwater Viral Ecology. //Genes.-2010.-№1(2).-Р.210-226.
- Sanders J.E., Garcia S.E. Pediatric herpes simplex virus infections: an evidence-based approach to treatment. //Pediatr. Emerg. Med. Pract.-2014.-№11(1).-Р.1-19.
- Toljamo K.T., Karttunen T.J., Memela S.T. et al. Herpes simplex and H.pylori infections in erosive gastritis. // GUT, 1997. – 41. – suppl.l. – A 129.
- Välimaa H., Seppänen M., Hukkanen V. Herpes simplex. //Duodecim.–2013.–№129(1).-Р.31-40.
- WHO Regional Office for Europe. Epidemiology of herpes simplex virus infections and surveillance of other STDs in Europe. // Report on a Workshop, 1955. WHO EUR, Copenhagen, 47 pp.
- Wylie K. M., Weinstock G. M., Storch G. A. Emerging view of the human virome. //Transl. Res.-2012.-№160.-Р.283-290.
- Wylie K. M., Weinstock G. M., Storch G. A. Virome genomics: a tool for defining the human virome. //Curr. Opin. Microbiol.-2013.-№16.-Р.479-484.
Стаття надана мовою оригіналу






