
 Стаття
Стаття
 25.02.2025
25.02.2025
Ацетонемический синдром у детей как энергодефицитное состояние: профілактика развития с применением диетической добавки «Асконова»
Зайцева Н.Е., Сапа И.Ю., Пьянкова А.В., Малолетняя С.В., Евграфова Н.Б., Корчемная Л.В. Киевский детский гастроэнтерологический центр, Киев, Украина; Детская клиническая больница № 9, Киев, Украина
Проблема профилактики и эффективного противорецидивного лечения ацетонемического синдрома (АС) у детей в последние десятилетия весьма актуальна. Это обусловлено его значительной распространенностью у детей первых лет жизни, ранней клинической манифестацией [2,6-7], возрастанием частоты выявления АС среди детей школьного возраста [5]. При рецидивах заболевания отмечается необходимость госпитализации более 50% пациентов [2, 3]. АС сопровождается высоким риском формирования таких социально значимых патологий, как метаболический синдром, подагра, мочекаменная и желчекаменная болезнь, ожирение, атеросклероз, ишемическая болезнь сердца, интерстициальный нефрит, нефрокальциноз, приводящих к потере трудоспособности и ранней смерти у взрослых пациентов, вследствие недостаточно эффективной противорецидивной терапии в детском возрасте [7, 14].
Сегодня в Украине нет единой точки зрения в отношении дифениций состояний, которые сопровождаются тошнотой, рвотой, абдоминальной болью, наличием кетонових тел в моче и крови. Их называют недиабетическим кетоацидозом, синдромом циклической ацетонемической рвоты, кетонурическим (ацетонурическим) синдромом, ацетонемическим синдромом, синдромом циклической рвоты (СЦР).
В МКБ-10 синдром циклической рвоты имеет код R 11 (тошнота и рвота) класса XVIII, в который включены «симптомы, признаки и отклонения от нормы, выявленные при клинических или других исследованиях, а также неточно обозначенные состояния, в отношении которых не указан какой-либо диагноз, классифицированный в других рубриках». Ацетонурия, как «отклонение от нормы, выявленное при исследовании мочи и при отсутствии диагноза», имеет код R 82.4 (рис. 1).
Кроме того, согласно Римским критериям III (2006), СЦР трактуется как функциональное гастроинтестинальное нарушение у детей и подростков и имеет код H 1b. Аналогично классифицируется СЦР и в «Унифицированных клинических протоколах медицинской помощи детям с заболеваниями органов пищеварения», утвержденных Приказом Министерства здравоохранения Украины № 59 от 29.01.2013 г., в котором отдельно даны рекомендации по ведению больных с синдромом циклической рвоты и вторичным ацетонемическим синдромом (синдромом ацетонемической рвоты, САР). При этом акцентируется внимание на том, что диагноз «СЦР» может быть выставлен только при условии безусловного исключения другой патологии, которая сопровождается рвотой [18].
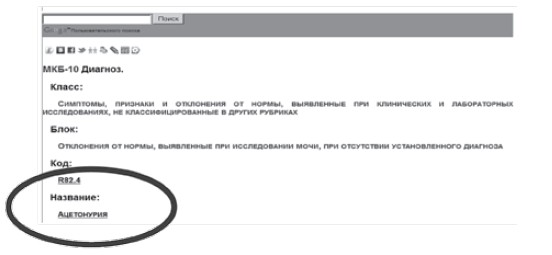
Рис. 1. Определение диагноза «Ацетонурия», согласно МКБ-10
С нашей точки зрения, патогенетически и клинически эти все понятия близки, что, по-видимому, в последующем будет способствовать их слиянию.
Отечественные педиатры в своей клинической практике наиболее часто используют термин «ацетонемический синдром», под. которым понимают периодические ацетонемические кризы (АК), характеризующиеся гиперурикемией, кетонурией и гиперкетонемией. Выделяют первичный и вторичный АС. Первичный (генетически детерминированный), или идиопатический АС рассматривают как аналог СЦР, акцентируя внимание на тождественности их патогенетических механизмов и клинических проявлений [1, 3, 9, 16]. В основе этого полиэтиологического заболевания лежат изменения активности гипоталамо-гипофизарно-надпочечниковой системы с повышением секреции кортикотропин-рилизинг фактора и нарушением вегетативной регуляции. Особо подчеркивается сходство АС (СЦР) и мигрени. Некоторые зарубежные авторы считают, что СЦР – это проявление митохондриальной дисфункции, в основе которой лежат патологические нарушения клеточного энергообмена и тканевого дыхания с повреждением различных звеньев цикла Кребса, дыхательной цепи, бета-окисления и др. [14, 19–21].
Еще до недавнего времени отечественные и российские ученые рассматривали АС в качестве клинического маркера генетически детерминированных особенностей обмена веществ (или, так называемой, нервно-артритической аномалии конституции), характеризовавшихся снижением активности ферментов печени (глюкозо-6-фосфатазы, гипоксинтин-гуанил-фосфорибозилтрансферазы), низкой ацетилирующей способностью ацетилкоэнзима А (ацетил-КоА), дефицитом щавелевой кислоты (ключевого фактора цикла Кребса) [2], нарушением белкового (пуринового), жирового и углеводного обменов, обусловленных изменениями эндокринной регуляции метаболизма [10, 11]. У части детей с АС выявляют также и особенности метаболизма соединительной ткани (множественные признаки ее дисплазии и стигмы дисэмбриогенеза [7].
В последнее десятилетие при первичном АС установлена роль одного из изоферментов системы цитохрома Р450 (CYP2Е1) печени, ответственного за метаболизм жирных кислот и кетоновых тел. Избыточное поступление жирных кислот, кетоновых тел при нарушении обмена веществ, различных патологических состояниях, воздействии ряда лекарственных препаратов приводит к индукции CYP2Е1. При этом образуется большое количество свободных радикалов, усиливаются процессы перекисного окисления липидов, происходит поражение митохондрий гепатоцитов и нарушение перекисного гомеостаза организма в целом [5].
Провоцирующими факторами развития АК наиболее часто становятся кетогенная диета, употребление излишнего количества животных жиров, стрессы, вирусные заболевания, психофизические перегрузки.
Вторичный АС встречается в 2–4 раза чаще первичного [6, 7, 16]. При этом предполагается, что первичный АС распространен шире, чем регистрируется. В большинстве случаев вторичный АС развивается на фоне инфекционных (в том числе, гельминтозов), соматических (прежде всего, функциональных нарушений пищеварительного тракта), эндокринных заболеваний и любых других патологических состояний, сопровождающихся токсикозом и приводящих к энергетическому дефициту.
На основании работ последних лет российскими авторами выдвинуто положение о наличии различных типов индивидуального цитоэнергетического статуса организма и существовании скрытой формы его относительной недостаточности. Представляется вероятным, что это состояние достаточно широко распространено, что накладывает свой отпечаток на течение различных болезней и требует определенной «энерготропной» коррекции. Так, именно при энергодефиците у детей наблюдается повышенная частота острых респираторных заболеваний, соединительно-тканных нарушений, вегетативных дисфункций и т.д. [17, 22].
Наиболее характерными клиническими признаками АС является повторяющаяся многократная рвота, головная боль, вялость, гемодинамические расстройства, специфический запах изо рта, которые обусловлены накоплением в крови кетоновых тел (ацетона, ацетоуксусной и бета-оксимасляной кислоты). Как правило, такие состояния обусловлены функциональной незрелостью печени и поджелудочной железы у детей.
Триггерами патологического процесса являются алиментарные (чрезмерное употребление жирной и белковой пищи), физические, интеллектуальные нагрузки, стрессовые и токсические состояния, сопровождающиеся повышенными энергозатратами. При этом у детей в результате недостаточного запаса гликогена в печени возникает относительный или абсолютный недостаток углеводов (прежде всего, глюкозы), являющейся универсальным источником энергии. Повышенные энергозатраты ведут к усилению липолиза, в результате котрого в печень поступает избыток свободных жирных кислот (СЖК) (рис. 2.), трансформирующихся в «универсальный» метаболит – ацетил-коэнзим А (ацетил-КоА) [4]. В условиях нормального обмена веществ основным путем метаболизма ацетил-КоА являeтся реакция с оксалоацетатом и дальнейшее участие его в цикле Кребса с образованием энергии. Часть ацетил-КоА используется для ресинтеза жирных кислот и образования холестерина. Только незначительная часть ацетил-КоА идет на образование кетоновых тел. При усилении липолиза количество ацетил-КоА избыточно. Кроме этого, ограничено его поступление в цикл Кребса в связи с уменьшением количества оксалоацетата. Также снижается активность ферментов, активирующих ресинтез СЖК и холестерина. В результате остается только один путь утилизации ацетил-КоА – кетогенез. Кетоз развивается в том случае, когда скорость образования кетоновых тел превышает скорость их утилизации периферическими тканями и выведения из организма. Значительное повышение уровня кетокислот ведет к метаболическому ацидозу с увеличенным анионным интервалом – кетоацидозу.
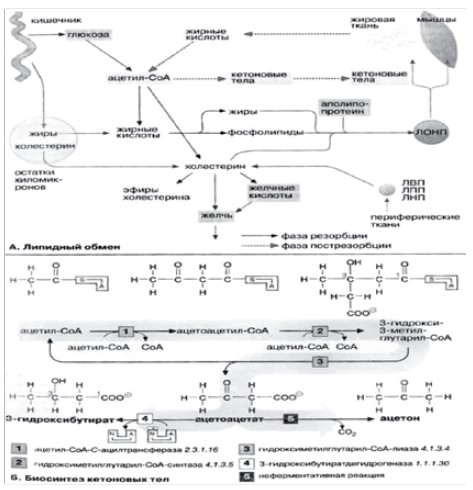
Рис.2 Биосинтез кетоновых тел
Согласно консенсусным рекомендациям Североамериканской ассоциации детской гастроэнтерологии, гепатологии и нутрициологии NASPGHAN (North American Society for Pediatric Gastroenterology, Hepatology and Nutrition, 2008), диагностическими критериями СЦР следует считать:
- как минимум 5 приступов на протяжении какого-либо промежутка времени или как минимум 3 приступа в течение 6-месячного периода;
- эпизодические приступы интенсивной тошноты и рвоты, которые продолжаются от 1 часа до 10 суток и наблюдаются не менее 1 недели отдельно;
- стереотипная структура и симптомы приступа у каждого отдельного пациента;
- рвота в период приступа развивается не менее 4 раз в час на протяжении как минимум одного часа;
- возвращение к здоровому состоянию между приступами рвоты;
- рвота не связана с другими заболеваниями [13, 14].
При вторичном АС кроме проявлений кетоза (тошнота, многократная продолжительная рвота, отказ от пищи и питья, боли в животе), особенности клинической картины определяются основной патологией, вызвавшей развитие кетоза. Улучшение состояния ребенка и ликвидация рвоты происходит по мере купирования симптомов основного заболевания. Для дифференциальной диагностики СЦР и вторичного АС обязательно проведение детального обследования с определением уровня электролитов крови, глюкозы, молочной кислоты, аммиака, аминокислот, АКТГ, креатинина, биохимических показателей, кетоновых тел и пр. Необходимо помнить, что ацетонемические кризы могут быть проявлениями самых различных заболеваний. Поэтому по показаниям проводят дополнительные методы исследования.
Лечение и про филактика
В лечении пациентов с АС выделяют два этапа: купирование АК и профилактические мероприятия в межприступный период, позволяющие предупредить рецидив патологии. И если лечебные мероприятия в период кризов хорошо известны педиатрам и детским гастроэнтерологам, то вопрос противорецидивной терапии пока разработан недостаточно.
Учитывая особую роль дефицита глюкозы в патогенезе развития ацетонемических состояний в период купирования АК, особенно при оказании помощи на раннем амбулаторно-поликлиническом этапе, кроме проведения егидратацинных и дезинтоксикационных мероприятий [1], патогенетически обоснованным является применение глюкозы, а также средств метаболической терапии, к которым относятся витамины-антиоксиданты. Не менее важным является применение этих средств и в межприступный период.
К таким препаратам, в полной мере, можно отнести диетическую добавку «Асконова» (производитель – Киевский витаминный завод, Украина), выпускаемую в виде таблеток трех видов: «Асконова антиоксидант», «Асконова. Железо со вкусом яблока» и «Асконова. Кальций со вкусом ананаса». Таблетки предназначены для разжевывания или рассасывания в полости рта. Их основу составляет глюкозы моногидрат (2 г) и аскорбиновая кислота (6 мг). В состав «Асконова антиоксидант» дополнительно включены бета-каротин (420 мкг) и витамин Е (0,8 мг). «Асконова железо» содержит, кроме глюкозы моногидрата (2 г) и аскорбиновой кислоты (6 мг), железа глюконат (1,5 мг), а «Асконова кальций» –кальция глюконат (13 мг). Энергетическая ценность продукта – 390,5 ккал/100 г.
За 2009–2012 гг. в Киевский детский городской гастроэнтерологический центр обратились 320 детей в возрасте от 1 до 12 лет, перенесших АК. Анализ клинико-анамнестических данных позволил установить, что у 255 (79,7%) детей первый эпизод АК развился на фоне ОРВИ и/или нарушения режима и рациона питания, а также пищевой аллергии и/или пищевой непереносимости, у 22 (6,9%) пациентов – психо-эмоциональных стрессов, у остальных – причина не была установлена.
У большинства детей АК развивались в 3-летнем возрасте и носили рецидивирующий характер (2–6 эпизодов за год). У 2 детей рецидивирующие АК были единственными проявлениями впоследствии установленной целиакии. У большинства пациентов была выявлена патология пищеварительного тракта в виде функциональных нарушений билиарной системы (дисфункций желчного пузыря и сфинктера Одди), поджелудочной железы, гастроинтестинальных проявлений пищевой аллергии (рецидивирующих абдоминальных болей, дисфункций кишечника в виде поносов и запоров, метеоризма, синдрома мальассимиляции и мальнутриции). У 22,8% детей в анамнезе имелась затяжная желтуха, сопровождающаяся длительно сохраняющимся (от 1 до 6 месяцев) повышением уровня печеночных ферментов (аланинаминотрансфераза–АЛТ, аспартатаминотрансфераза–АСТ, гамма-глютамилтранспептидаза– ГГТП, щелочная фосфатаза–ЩФ) в крови. У 144(45%) детей в наследственном анамнезе отмечались желчнокаменная болезнь, артериальная гипертензия, сахарный диабет 2-го типа. Диагноз «СЦР» (первичный АС) устанавливали путем исключения других патологических состояний, сопровождающихся подобными симптомами. Кроме общеклинического исследования периферической крови и мочи определяли уровень электролитов, глюкозы, показателей белкового и липидного обмена, печеночных ферментов в сыворотке крови, гликемический профиль, уровень диастазы (амилазы) в крови и моче, показатели транспорта солей в суточной моче, содержание кетонов в моче, проводили ультразвуковое исследование органов брюшной полости, по показаниям использовали другие инструментальные методы (колоноскопия, фиброэзофагогастродуоденоскопия и пр.), лабораторные тесты.
Комплексная терапия пациентов проводилась в соответствии с «Унифицированными клиническими протоколами медицинской помощи детям с заболеваниями органов пищеварения» Министества здравоохранения Украины. В период приступов она включала препараты для оральной регидратации, прокинетики, спазмолитики, энтеросорбенты, пищеварительные ферменты, гепатопротекторы, пробиотики в возрастных дозировках. При тяжелом течении АК в условиях стационара проводили инфузионную и посиндромную терапию.
С целью предупреждения рецидивов синдрома циклической рвоты 30 детям в возрасте от 4 до 12 лет (основная группа) было рекомендовано применение диетической добавки «Асконова антиоксидант» в межприступный период в следующих дозировках: в возрасте от 4 до 6 лет – 4–6 таблеток, 7–10 лет – 6–8 таблеток, с 10 лет – до 10 таблеток в день. Длительность профилактического приема составляла 10 дней каждого месяца на протяжении года. При появлении первых симптомов АК, ОРВИ, ОКИ, нарушении рациона питания (злоупотреблении кетогенными продуктами, голодании), эмоциональных и физических стрессовых состояниях, было рекомендовано дополнительное применение диетической добавки «Асконова антиоксидант» в течение 7–10 дней.
Выбор комплекса глюкозы с витамином С, Е и бета-каротином «Асконова антиоксидант» в качестве средства профилактики рецидивов СЦР был обусловлен двойным механизмом действия компонентов средства: восполнением недостатка глюкозы при развивающемся энергодефиците, предотвращением образования и избыточного накопления токсичных кетонов, а также цито- и актопротекторной способностью витаминов-антиоксидантов обеспечивать дополнительную защиту клеток организма от действия агрессивных свободных радикалов.
Контрольную группу составили 20 детей с рецидивирующим АС такого же возраста, не получающих диетическую добавку. Семейный анамнез и особенности клинического течения патологии в обеих группах детей достоверно не отличались. Качественные показатели сравнивали при помощи критерия Фишера (угловое преобразование Фишера). Статистически достоверной считали разницу при р<0,05. Результаты наблюдений представлены в таблице.
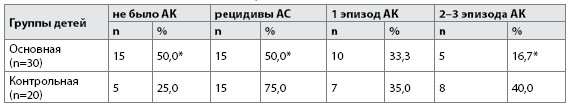
Примечание: * (р<0,05) разница достоверна по сравнению с контрольной группой; n – количество детей
Выявлено, что в основной группе обследованных эпизодов АК в течение года не возникало у половины –15 (50,0%) детей, тогда как в контроле их не было только у 5 (25,0%) (р<0,05). Количество детей с рецидивами АК составляло 15 (50,0%) в основной группе и 15 (75,0%) в контрольной (р<0,05).
В основной группе один эпизод АК возник у 10 (33,3%) детей против 7 (35,0%) пациентов контрольной группы; 2–3 эпизода АК наблюдались у 5 (16,7%) детей основной и у 8 (40,0%) обследованных контрольной группы (р<0,05).
Следует отметить, что своевременное применение диетической добавки «Асконова антиоксидант» на самых ранних этапах развития кетоацидоза с одновременным применением средств оральной регидратации приводило к быстрому купированию патологического состояния, благодаря чему не возникала необходимость во врачебном вмешательстве.
«Асконова» имеет хорошую переносимость и высокий профиль безопасности, не содержит красителей и консервантов.
Противопоказаниями к применению средства являются повышенная индивидуальная чувствительность к ее компонентам и сахарный диабет.
Детям с проявлениями анемии целесообразно чередовать «Асконова антиоксидант» с «Асконова железо» для дополнительной профилактики железодефицитных состояний, а при быстром росте ребенка, патологии зубов и опорно-двигательного аппарата – с «Асконова кальций».
Выводы
Диетические добавки линейки «Асконова» являются перспективным и эффективным патогенетически обоснованным средством профилактики нарушений энергетического обмена и развития ацетонемических состояний у детей разных возрастных групп.
Использование диетических добавок «Асконова» у детей с АС в межприступный период способствуют достоверно значимому снижению частоты (в 2 раза) и тяжести ацетонемических кризов.
Детям с АС для физиологического (естественного) нивелирования действия триггерных факторов (психо–эмоциональный стресс, физические и умственные нагрузки, нерациональное питание, заболевания органов пищеварения), а также для сезонной адаптации в детских учреждениях, целесообразно круглогодично использовать диетические добавки линейки «Асконова» с метаболическим, цито- и актопротекторным эффектами прерывистыми курсами по 10 дней каждого месяца.
Диетические добавки линейки «Асконова» имееют хорошие органолептические свойства, высокий профиль безопасности и хорошо переносятся детьми разных возрастных групп
Литература
- Бережной В.В., Корнева В.В., Козачук В.Г., Курило Л.В., Боярская Е.А., Капичина М.А., Чоботарь А.В. Ацетонемический синдром детей – тактические шаги доктора-практика // Современная педиатрия. – 2012. –№ 2(42). – С. 1–6
- Волосовец А.П., Кривопустов С.П., Кожина А.Н., Щербинская Е.Н. Ацетонемический синдром у детей: современный взгляд на проблему // Журнал «Здоровье ребенка». – 2009. – № 6 (21). – С. 76–81
- Дука Е.Д., Ярошевская Т.В., Недава О.А., Сапа Н.Б. Новые подходы к лечению детей с ацетонемическим синдромом // Журнал «Здоровье ребенка». – 2011. – № 3 (30). – С. 66–71
- Зайчик А.Ш., Чурилов Л.П. Основы патохимии. – С.-Петербург: Элби-СПб-2000. – 687 с.
- Ивашкин В.Т. Ядерные рецепторы и патология печени. Часть 1-я // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2010. – № 3.-С. 4–8.
- Казак С.С., Бекетова Г.В. Ацетонемічний синдром у дітей // Нова медицина. – 2003. – № 2. – С. 58–61.
- Казак С.С., Бекетова Г.В. Діагностика та дієтотерапія ацетонемічного синдрому у дітей // Ліки України. – 2005. – № 1. – С. 83–86.
- Конюшевская А. А., Ярошенко С. Я., Кехиопуло О. И., Франчук М. А., Золото И. С., Асташева В. И., Воробьева В. Ю. Некоторые факторы, влияющие на развитие ацетонемического синдрома у детей. // Международный медицинский вестник. – 2011. – Том 4. – № 1–2. – С. 125–126.
- 9. 9.Корнева В.В., Козачук В.Г., Курило Л.В., Унич Н.К., Боярская Е.А., Капичина М.А. Ацетонемический синдром у детей. Возможности оптимизации терапии // Сучасна гастроентерологія. – 2011. – № 2 (58). – С. 89–95.
- Кривопустов С.П. К вопросу об ацетонемическом синдроме у детей // Журнал «Дитячий лікар». – 2011. – № 3. – С. 5–7.
- Овчаренко Л.С., Жихарева Н.В. Новый взгляд на возникновение метаболического синдрома // Журнал «Здоровье ребенка». – 2007. – № 1(4). – С. 115.
- Охотнікова О.М., Гладуш Ю.І., Іванова Т.П., Грищенко О.М., Зарудня О.Ф., Мостовенко Р.В., Руденко С.М., Сіладі Й.Й. Ацетонемічний синдром у педіатричній практиці: діагностична підступність і непередбачуваність! // Дитячий лікар – 2011. – №4. – С. 10–18.
- Пипа Л.В., Свістільнік Р.В., Леньга В.Р., Свістільнік Т.В., Поліщук В.А. Синдром циклічної блювоти у дітей. Сучасні погляди і останні рекомендації щодо ведення хворих. Частина 1// Журнал «Здоровье ребенка». – 2011. – № 3 (30). – С. 105–111.
- Пипа Л.В., Свістільнік Р.В., Леньга В.Р., Свістільнік Т.В., Поліщук В.А. Синдром циклічної блювоти у дітей. Сучасні погляди і останні рекомендації з ведення хворих Частина 2 // Журнал «Здоровье ребенка».-2011. – № 4 (31). – С. 98–103.
- Рябчук Ф. Н. , Пирогова З. И. Коэнзимное ацетилирование и уровень свободных жирных кислот крови у детей с ацетонемией и билиарной недостаточностью //Журнал «Лечащий врач». – 2012. – № 8. – С.42-47.
- Сенаторова А.С., Осипенко Е.В. Ацетонемический синдром у детей// Журнал «Здоровье ребенка». – 2007. – № 5 (8). – С.42-46.
- Сухоруков В.С. К разработке рациональных основ энерготропной терапии // Здоров’я України. – 2007. – № 2. – С. 40-47.
- Уніфіковані клінічні протоколи медичної допомоги дітям із захворюваннями органів травлення. Додаток 2 до Наказу МОЗ України № 59 від 29.01.2013
- Boles R.G., Williams J.C. Mitochondrial disease and cyclic vomiting syndrome // Dig. Dis. Sci – 1999. – Vol. 44. – P. 103–107.
- Differentiating cyclic from chronic vomiting patterns in children: quantitative criteria and diagnostic implications / B.T. Pfau, B. Li, R.D. Murray et al. // Pediatrics. – 1996. – Vol. 97. – P. 364–368.
- North American Society for Pediatric Gastroenterologe, Hepatology and Nutrition Consensus Statement on the Diagnosis and Management of Cyclic Vomiting Syndrome / B. Li, F. Lefevr, G.G. Chelminsky et al. // J. Pediatr. Gastroenterol. Nutr. – 2008. – Vol. 47. – P. 379–393
- Sukhorukov V.S. Energy deficient diathesis as energy metabolism disadaptation in children. Mat. of VIII World Congress of Int. Soc. for Adaptive Medicine, Moscow 2006, II-1.19. – Р. 54.
Стаття надана мовою оригіналу





