Продукція
Препарати зареєстровані в Україні
УДК 618.17
Корекція гіперандрогенних порушень у жінок із синдромом полікістозних яєчників
Герасимова Т.В., Гопчук О.М.
Національна медична академія післядипломної освіти ім. П.Л. Шупика Жіноча консультація ЦРП Печерського району
Резюме
В статті представлена інформація, присвячена проблемі порушення репродуктивної функції на cиндрому гіперандрогенії. Наведено дані ефективності і безпеки застосування полікомпонентного органічного препарату «Стиміфол» в комплексі терапії, з метою нормалізації гормонального статусу в жінок із порушенням менструального циклу.
Ключові слова: гіперандрогенний синдром, полікістоз яєчників, надмірна вага, Стиміфол, Гарцинія
Гіперандрогенія – клінічний синдром, що розвивається внаслідок надлишкового (абсолютного або відносного) вмісту в крові вільних форм андрогенів. І це не дивлячись на те, що наявність в організмі жінки андрогенів (тестостерону, андростендіону) – біологічна необхідність: вони є незамінним субстратом для синтезу в яєчниках, жировій і нервовій тканинах естрогенів [1].
Андрогени стимулюють секреторні і анаболічні процеси в тому числі і процес розмноження, активують лібідо. Завдяки різним точкам прикладання і пов’язаними з цим ефектами саме баланс концентрації андрогенів зумовлює гармонічне функціонування як репродуктивної, так і інших органів і систем.
Є декілька основних джерел синтезу андрогенів [2]:
- яєчники (тека-клітини внутрішньої оболонки фолікула і строма);
- наднирники (сітчаста зона кори);
- периферичні тканини (жирова клітковина, шкіра, скелетні м’язи, головний мозок).
У регуляції синтезу андрогенів беруть участь:
- В яєчниках:
-ЛГ
-ФСГ
-інтрояєчникові фактори росту (ІФР та ін.)
- У наднирниках:
-АКТГ
Найбільш активним метаболітом є дигідротестостерон (ДГТ).
Основні напрямки дії андрогенів в різних органах:
- Внутрішньогонадна дія андрогенів:
-беруть участь в процесах утворення домінантного фолікула;
-сприяють зростанню фолікула;
-при високих концентраціях викликають атрезію фолікула
- Центральна дія андрогенів:
-пригнічення пульсуючої секреції Гн-РГ і ГТ за принципом зворотного зв’язку;
-пригнічення секреції ФСГ шляхом стимуляції інгібіну в клітинах гранульози;
- Периферична дія андрогенів:
-атрофічні процеси в ендометрії і міометрії;
-гіпоплазія матки;
-атрофія залозистої тканини молочної залози, пригнічення лактації.
Згідно з сучасними даними гіперандрогенія спостерігається у 10-20% жінок і відіграє провідну роль у патогенезі синдрому полікістозних яєчників (СПКЯ), стромального текозу яєчників, гірсутизму, акне, себореї, андрогенної алопеції.
Гіперандрогенія – причина порушень оваріально-менструального циклу (аменорея та ін.), ановуляторного безпліддя і пов’язана з підвищеним ризиком метаболічних розладів (ожиріння, цукровий діабет ІІ типу, рак яєчників і матки, серцево-судинні патології). Особливу групу гіперандрогенних станів, які можна назвати природною, або віковою, гіперандрогенією, складають пубертатні та постменопаузальні ускладнення. Передчасне адренархе нерідко є першим маркером ряду метаболічних порушень, що призводять у статевозрілих жінок до розвитку метаболічного синдрому або «Х-синдрому» [3].
Класифікація Гиперандрогения станів (І.І.Дедов) [4].
I. Непухлинні (функціональні) форми "істинної" гіперандрогенії:
- синдром полікістозних яєчників (СПКЯ);
- стромальний текоматоз яєчників, гіпертекозний (HAIR-AN) синдром;
- вроджена гіперплазія кори надниркових залоз (класична і некласична форми);
- гіперпролактинемія;
- гіперкортицизм (хвороба і синдром Іценко-Кушинга);
- акромегалія.
II. Опухолевие форми "істинної" гіперандрогенії:
- андрогенпродукуючі пухлини яєчників (андробластоми, ліпідоклітинні пухлини, текоми та ін.)
- андрогенпродукуючі пухлини надниркових залоз (андростероми, кортикоандростероми).
III. Транспортні (диспротеїнемічні) форми гіперандрогенії – зниження продукції у печінці глобуліну, що зв'язує статеві стероїди (ГЗСС):
- гепатити, цироз;
- гіпотиреоз;
- гіпоестрогенія;
- прийом екзогенних андрогенів, анаболічних стероїдів, глюкокортикоїдів.
IV. Рецепторна форма гіперандрогенії – підвищення активності 5α-редуктази в клітинах-мішенях:
- Спадково-конституційна (генетична або ідіопатична) форма
- Зміна активності 5α-редуктазної системи під впливом зовнішніх факторів.
Гормонально-активні злоякісні пухлини ендокринних органів підлягають невідкладному хірургічному лікуванню. У повсякденній клінічній практиці лікар найчастіше стикається з гіперандрогенією непухлинного генезу, - функціональною гіперандрогенією.
Відомо, що естрогени стимулюють синтез ГЗСС в печінці. В умовах естрогенного дефіциту може спостерігатися відносне підвищення рівня вільних андрогенів, - при діагностиці важливо враховувати визначення рівня естрогенів і фракцій андрогенів, а не тільки їх загальний вміст, який може залишатися нормальним. У 20-30% пацієнток з гірсутизмом, в крові визначається нормальний рівень загального тестостерону, у зв’язку з цим необхідно враховувати наявність такого стану як відносна гіперандрогенія [5].
Основними причинами відносної гіперандрогенії є наступні:
- Підвищена активність ферменту 5a-редуктази I типу;
- Підвищена щільність ядерних дигідротестостерон-рецепторів;
- Збільшення вільної фракції тестостерону в крові як результат зменшення синтезу СГСГ в печінці.
Метою лабораторної діагностики гіперандрогенних станів є визначення функціонального стану яєчників і надниркових залоз, виключення гіперпролактинемії, гіпотиреозу. Для цього досліджують і аналізують такі показники, як:
- Тестостерон загальний
- Тестостерон вільний
- Індекс вільного тестостерона
- Естрадіол
- Глобулін, що зв’язує статеві стероїди (ГЗСС)
- Дегідроепіандростерон сульфат (ДГЕАС)
- 17-ОН-прогестерон
- ЛГ, ФСГ і їх співвідношення
Важливим діагностичним критерієм є дослідження індексу вільного тестостерону ((ІВТ), Free androgen index, FAI) – розрахунковий показник, що визначає співвідношення молярної концентрації загального тестостерону до молярної концентрації ГСПС виражене у відсотках [6].
Лікування гіперандрогенії проводитися з урахуванням етіологічного фактора і є комплексним, із застосуванням гормонотерапії симптоматичних препаратів (таблиця 1). Обов'язковим компонентом терапії гіперандрогенії є застосування гепатопротекторів.
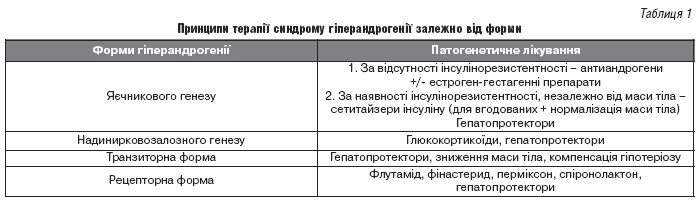
Звертаючись до даних сучасних досліджень (La Colaboración Cochrane Revisiones Cochrane) ми отримали доказові дані про взамзв’язок функцій репродуктивної, гепатобіліарної та нервової систем. Гастроінтестинальні пептиди (холецистокінін, вазоактивний інтестинальний поліпептид та ін.) продукуються як в ЦНС, так і в шлунково-кишковому тракті. Це пояснює поєднання захворювань шлунково-кишкового тракту і гіпоталамічних розладів [4].
Хронічні запальні процеси в печінці через прямі та зворотні нервові і гуморальні зв'язки можуть викликати розвиток гіпоталамічного синдрому [2].
Гіпоталамічні порушення будь-якої етіології можуть призвести до дистрофічних змін у печінці або дискінезії жовчовивідних шляхів, що веде до порушень її функції, а особливо – білковопродукуючої.
Запальні захворювання генітальної та екстрагенітальної локалізації, в т.ч вірусної етіології – причина функціональної гіперандрогенії [7].
Гіперандрогенний стан є один із основних компонентів метаболічного синдрому. Метаболічний синдром у жінок репродуктивного віку практикуючі лікарі знали раніше як нейро-обмінно-ендокринний синдром, що протікає по типу легкої форми хвороби Кушинга. У жінок репродуктивного віку МС в поєднанні із СПКЯ є однією з найбільш частих причин ановуляторного безпліддя, ранніх втрат вагітності. Частота даної патології становить приблизно 30 - 35% у структурі порушень репродуктивної функції і до 70% серед пацієнток з рецидивуючими гіперпластичними процесами ендометрію [8].
Під впливом різних факторів (пологи, аборти, нейроінфекції, стреси, операції, травми та ін.) Порушується нейроендокринна регуляція функції гіпоталамуса. Тому відмічається безліч діенцефальних симптомів (порушення сну, апетиту, спрага, запаморочення, головні болі, гіпертензія та ін.), Що вказують на центральний (гіпоталамічний) генез даної патології. У патогенез МС включають кілька систем: гіпоталамус-гіпофіз-наднирники, гіпоталамус-гіпофіз-яєчники, аутокринна та ендокринна системи вісцеральної жирової тканини [9].
Ключову роль у регуляції репродуктивної функції відіграють гонадотропін-рилізинг гормони, при цьому гіпоталамус реагує на зміну рівня естрогенів. Зв’язок між кількістю жирової тканини і вмістом естрогенів була виявлена в ряді досліджень, які виявили, що в жировій тканині відбувається ароматизація андрогенів і таким шляхом утворюється третина циркулюючих естрогенів [16]. Надлишок жирової тканини призводить до накопичення стероїдів, і кількість і активність циркулюючих в крові естрогенів знижується. Аномальне функціонування гіпоталамуса призводить не тільки до нерегулярних менструальних циклів, але і до гіпоместруального синдрому та вторинної аменореї [17].
При вивченні менструальної функції у жінок з післяпологовим ожирінням виявили порушення тонічної і циклічної секреції гонадотропінів, що в 63% випадків приводить до розвитку ановуляторних кровотеч, з подальшим розвитком гіпоменструального синдрому або ациклічних кровотеч на тлі гіперпластичних процесів ендометрія.
Наслідком порушення нейроендокринної контролю функції гіпоталамуса є підвищення секреції і виділення адренокортикотропного гормону (АКТГ), пролактину; також порушується цирхорального ритм виділення гонадоліберину і, відповідно, гонадотропінів в гіпофізі. Естрон, що синтезується внегонадно з андрогенів, підвищує чутливість гіпофіза до гонадолиберином, що призводить до формування вторинних полікістозних яєчників (ПКЯ) [18].
На думку більшості дослідників, вторинні порушення менструального циклу і є наслідком ожиріння. При аліментарному ожирінні в 6 разів частіше відзначаються порушення менструальної функції і майже в 2 рази частіше – первинне безпліддя. Є пряма залежність між наростанням маси тіла і тяжкістю порушень оваріальної функції, що супроводжується ановуляцією, неповноцінністю лютеїнової фази циклу і зниженням кількості вагітностей.
Порушення нейромедіаторного контролю за функцією центрів харчової поведінки, які знаходяться в гіпоталамусі, призводить до підвищеного споживання їжі і ожиріння.
Наднирникові андрогени (ДГЕА-С, тестостерон) і тестостерон, що синтезується в жировій тканині, також сприяють периферичної інсулінорезистентності. У жінок з ожирінням і ановуляцією виявляються більш високі концентрації естрону, естрадіолу і / або вільного естрадіолу, ніж в ранню фолікулярну фазу у жінок з ожирінням та збереженою овуляцією, а також з нормальною масою тіла. Тонічне підвищення рівня естрогенів, що утворюються в результаті периферичної конверсії андрогенів, за механізмом позитивного зворотного зв'язку діє на гіпофіз. Підвищене вивільнення біологічно активного лютеїнізуючого гормону (ЛГ) веде до стимуляції продукції андрогенів стромою яєчників. Утворені в підвищених концентраціях андрогени слугують додатковими попередниками для подальшої ароматизації і перетворення в естрогенів в адипоцитах – так замикається "порочне коло" [19].
У жінок із ожирінням та метаболічним синдромом гіперандрогенія та полікістозні яєчники (ПКЯ) формуються не тільки як наслідок метаболічних змін, але й внаслідок первинного порушення нейромедіаторного контролю секреції гонадоліберину. Надлишок андрогенів первинно з надниркових залоз, а потім з ПКЯ надходить в жирову тканину, де підвищується синтез естрону. Естрон, що синтезується внегонадно, призводить до розвитку гормональнозавісімих захворювань в репродуктивній системі.
В результаті вищеописаних ендокринно-метаболічних порушень різко збільшується продукція андрогенів. Необхідно чітко уявити джерела андрогенів, на які необхідно впливати при призначенні лікування. Можна виділити такі основні джерела гіперпродукції андрогенів: наднирники, жирова тканина, гіперінсулінемія, полікістозні яєчники. Кардинальною ознакою МС є порушення менструальної і генеративної функцій на тлі прогресуючої збільшення маси тіла (МТ). Основними скаргами пацієнток є: порушення менструального циклу, невиношування вагітності, безпліддя, надмірне оволосіння, ожиріння і різні діенцефальні скарги. Причому надлишкову масу тіла (НМТ) пацієнтки пов’язують з ендокринними порушеннями, а не з аліментарними чинниками. Тільки при ретельно зібраному анамнезі можна виявити наявність підвищеного апетиту і неадекватного ставлення до кількості споживаних калорій. Це пов’язано з порушенням функції центрів харчової поведінки, які знаходяться в гіпоталамусі. Спадковість у більшості пацієнток обтяжена порушеннями репродуктивної функції, ожирінням, інсуліннезалежним цукровим діабетом (ІНЦД), ССЗ [20].
У разі настання вагітності виникає ряд ускладнень: загроза переривання вагітності, нерідко гіпотрофія плода, фетоплацентарна недостатність, переношена вагітність, розвиток гестозів, аж до важкої форми еклампсії і загибелі плода [21].
Таким чином, перерозподіл жирової тканини і накопичення її в абдомінально-вісцеральній ділянці у жінок в період вікового зниження функції яєчників різко збільшує ризик розвитку патології яєчників і пов’язане з розвитком різних метаболічних, ендокринних, психоемоційних та інших розладів. В даний час є великі можливості для проведення терапії, але в гінекологічній практиці ми часто не враховуємо те, що при лікуванні практично всіх захворювань, що супроводжуються ожирінням, основним або першим етапом ведення жінок має бути зменшення маси тіла.
Відомо, що обмеження біодоступності нутрієнтів досягається за допомогою препаратів, що ускладнюють перетравлення і всмоктування їжі. Найефективніший шлях боротьби з надмірною вагою – збільшення витрат енергії, що досягається збільшенням фізичної роботи. Цьому сприяють препарати, що підсилюють ліполіз, окислення глюкози і жирних кислот, та стимулюють теплопродукцию. Анорексигенні засоби представлені в основному похідними симпатоміметика фенаміну фентерміном, інгібіторами зворотного захоплення серотоніну і дофаміну (фенфлурамін, дексфенфлурамін). Однак, недостатня безпека і переносимість симпатоміметиків при лікуванні ожиріння різко обмежують їх застосування. Інгібітори травних ферментів отримали клінічне підтвердження ефективності, але можливості інгібіторів кишкових ліпаз обмежуються зменшенням переварювання жирів і незадовільною переносимістю [22]. У комплексній терапії гіперандрогенії застосовують й інші препарати, хоча і з меншим успіхом: бігуаніди; засоби, що регулюють метаболізм.
Препарат Стифімол виробництва ПАТ «Київський вітамінний завод» є актуальним препаратом для включення в схеми корекції гіперандрогенних станів у жінок з метою нормалізації ваги тіла та корекції метаболічних розладів.
Основний компонент препарату – екстракт Гарцинії камбоджійської (Garcinia cambogia) містить гідроксилимонную кислоту.
Гідроксилимонная кислота (ГЛК) інгібує ліпогенез (утворення жиру), знижує утворення холестерину і жирних кислот, збільшує вироблення глікогену в печінці, знижує апетит, активує термогенез, тим самим збільшує вироблення тепла. Піколінат хрому регулює вуглеводний, ліпідний обмін холестерину в організмі і сприяє підтримці нормального фізіологічного рівня глюкози в крові. Для поліпшення засвоєння використовується термосинтезуюча суміш на основі L- тирозину і L- карнітину, який підвищує проникність клітинних мембран для жирних кислот. Не збільшуючи швидкості розпаду жирової тканини, L- карнітин підвищує утилізацію ліпідів з метою енергозабезпечення і, в результаті, уповільнює швидкість синтезу молекул жиру в підшкірно-жирових депо. Таким чином, з початком прийому L- карнітину починається стійка втрата жирової тканини, при цьому різко підвищується ефективність окиснення жирів в організмі, оскільки жирні кислоти дають вже не токсичні вільні радикали, а енергію, що запасається у вигляді АТФ. L- тирозин бере участь у синтезі нейромедіатора норадреналіну і є попередником L- тироксину. Одна з головних тканин-мішеней катехоламінів в організмі – жирова тканина. Адреналін і норадреналін стимулюють у ній ліполіз через В1-адренергічні рецептори, які через систему цАМФ активують (шляхом фосфориляції) «гормон-чутливу» ліпазу триацилгліцеролів. Адреналін викликає також ліполіз триацилгліцеролів у м’язових клітинах через систему цАМФ. Тирозин пригнічує апетит, сприяє продукції мелатоніну, покращує функцію щитовидної залози і надниркових залоз, крім того бере участь у регуляції емоційного стану – допомагає зняти відчуття тривоги та подолати депресію.
Екстракт бурих водоростей активізує метаболічні процеси, що сприяє розщепленню жирів в жировій тканині, мінерали, що містяться в ньому, сприяють корекції метаболічних порушень.
Механізм дії Стифімолу ґрунтується на синергізмі вищеперелічених природних інгредієнтів, що входять до його складу, і пов’язаний з активацією метаболічних процесів, ліполізу, термогенезу, нормалізацією жирового обміну, зниженням утворення холестерину і жирних кислот, що призводить до зменшення відкладення жиру в тканинах і нормалізації маси тіла, а також до зниження апетиту. Наявність вищевказаних властивостей препарату дозволяє використовувати його в осіб з надлишковою масою тіла, при схильності до ожиріння, при використанні дієт – для зменшення відчуття голоду, що в кінцевому підсумку дозволить підвищити якість життя і соціальну активність пацієнтів. Вище вказувалося, що недоліком багатьох рекламованих засобів для лікування ожиріння є не завжди доведена їх ефективність [23].
Препарат Стифімол рекомендований до прийому по 1 капсулі 2-3 рази на добу, перед їжею, запиваючи склянкою води протягом 4-х тижнів, при:
-первинному ожирінні;
-при використанні дієт, для зменшення відчуття голоду.
Препарат добре переноситься і рідко викликає побічні ефекти, які, як правило, пов’язані з індивідуальним несприйнятністю одного з компонентів.
Клінічне випробування препарату Стифімол проведено відповідно до вимог, що пред’являються до подібного роду дослідженням Державним фармакологічним центром МОЗ України. Результати клінічного дослідження дозволили зробити висновок, що препарат Стифімол має достатню терапевтичну ефективність, знижуючи надлишкову масу тіла у хворих з первинним ожирінням І ступеня в середньому на 5% [23].
Відносно лікарського препарату Стифімол були проведені клінічні дослідження для України з вивчення його ефективності і переносимості у хворих з первинним ожирінням І ступеня на тлі базової терапії (дієтотерапії), 2007 г. Дослідження були проведені на трьох клінічних базах: кафедрі гастроентерології та терапії ФПО Дніпропетровської державної медичної академії (зав.кафедри, професор Ю.М.Степанов), кафедрі гастроентерології, дієтології та ендоскопії Національної медичної академії післядипломної освіти ім. П.Л.Шупика (зав. Кафедрою, професор Н.В.Харченко), кафедрі гастроентерології Харківської медичної академії післядипломної освіти (зав.кафедрою, професор Т.Д. Звягінцева). Переносимість препарату оцінювалася на підставі даних опитування, об'єктивних даних, отриманих в ході дослідження, даних лабораторних досліджень крові та сечі (клінічного аналізу крові, загального аналізу сечі, біохімічного аналізу крові, Т3, Т4).
Проведені дослідження переконливо довели гарну переносимість препарату, а також високу його ефективність – зниження індексу маси тіла більш ніж на 5% реєструвалося у 42-94% випробовуваних, помірна ефективність спостерігалася у 58-82% досліджуваних, що дозволило рекомендувати препарат як ефективний засіб в комплексі заходів для лікування ожиріння.
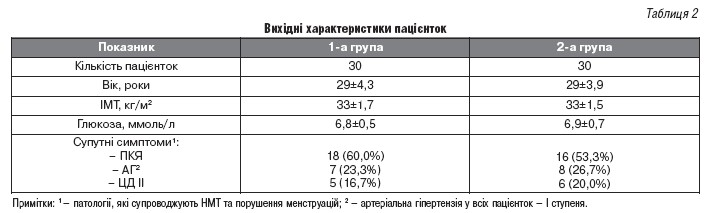
Для вивчення можливостей застосування Стифімолу в практиці лікаря -гінеколога, нами було проведено дослідження, метою якого було вивчення ефективності препарату Стифімол у жінок із порушенням менструальної функції на фоні полікістозу яєчників. Критерієм включення в т.ч.була наявність надмірної ваги тіла (середнє значення ІМТ становило 33 + 1,7 кг / м2).
До групи дослідження увійшли 30 жінок із гіперандрогенією на фоні СПКЯ та симптомами порушення менструального циклу по типу оліго- та опсоменореї. Стифімол жінки приймали по 1 капсулі 3 рази на день у складі комплексної терапії поряд із базовою терапією СПКЯ; контрольну групу склали 30 жінок, які в ході лікування отримували лише базисну терапію лікування СПКЯ (КОК, бігуаніди, гепатопротектори). Характеристики досліджуваних вказані в таблиці 1. Тривалість лікування склала 28 днів. Препарат добре переносився пацієнтками, не викликав патологічних відхилень у клінічних та біохімічних показниках у обстежуваних основної групи і не чинив виражених побічних реакцій.
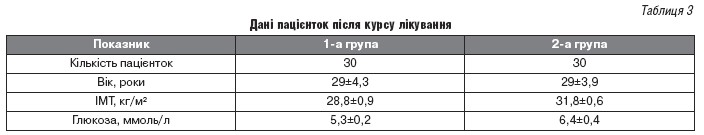
У пацієнток основної групи, на фоні терапії із використанням «Стиміфолом» відзначено тенденцію до нормалізації показників вуглеводного обміну, а саме зниження показників глікемії натще: з 6.8 ± 0.5 ммоль/л до 5.3 ± 0.2 ммоль/л (22.1 %), в порівнянні з контрольною групою з 6.9 ± 0.7 ммоль/л до 6.4 ± 0.4 ммоль/л (8.8 %). Більше того, клініка супутніх захворювань пацієнток після лікування проявляється значно менше. Цифрові дані пацієнток після курсу лікування наведені в Таблиці 2.
З літератури відомо [16], що істотні позитивні зміни в характері менструального циклу слід очікувати при продовженні базової терапії зменшенні маси тіла більше 10% від вихідних значень. У зв’язку з цим зрозуміло, що у частини хворих, як правило, з недостатнім зменшенням маси тіла, повного клінічного ефекту у вигляді нормалізації ритму менструацій не відзначено, хоча позитивний вплив терапії все ж проявлявся, що виражалося в зменшенні тривалості затримок менструацій. Частота олігоменореї знизилася приблизно в 5 разів протягом півроку спостережень після закінчення терапії.
Серед жінок досліджуваної групи у 22 (73.3 %)відновилася нормальна менструальна функція, а цикл встановився вже через 4-5 місяців після проходження терапії. В контрольній групі менструації з нормальним циклом відновилися у 6 пацієнток, у 3 вони стали тривати довше, але регулярний цикл ще не відновився, у решти – динаміка відновлення репродуктивної функції мало змінилася.
Після курсу прийому препарату зниження маси тіла склало в середньому 9.2 ± 0.75%. Слід зазначити, що після одного курсу терапії приблизно 1/3 хворих маса тіла знизилася більш ніж на 13% від вихідних значень.
Крім того, застосування препарату Стифімол призвело до більш вираженого зменшення обвіду талії (ОТ), порівняно з обвідом стегон (ОС), результатом цього стало достовірне зниження коефіцієнта ОТ / ОС і відповідно зменшення частоти абдомінального ожиріння, щодо групи контролю, що знаходилася на дієтотерапії. Проведену терапію можна вважати досить успішною, оскільки зниження маси тіла навіть на 5-10% вже достатньо для зменшення частоти розвитку патологічних станів як то ССЗ, ЦД [3].
Слід зазначити, що зниження маси тіла на тлі прийому Стифімолу відбувалося переважно за рахунок втрати надлишку жирової тканини. Зниження маси тіла супроводжується корекцією не тільки метаболічних, але і гормональних параметрів. Так, контрольне обстеження через 3 місяці після терапії показало достовірне зменшення вмісту ЛГ, збільшення СТГ, що призводило до закономірного зниження як загальних, так і вільних фракцій андрогенів, надлишок яких негативно впливає на процеси дозрівання фолікулів. Зниження рівня циркулюючих андрогенів можна розглядати як результат втрати маси тіла та зменшення рівнів інсуліну [6, 14].
У досліджуваній групі середнє значення ІМТ після закінчення терапії склало 28.8 ± 0.9 кг / м2 (16.8 %), в порівнянні з групою контролю, де цей показник склав 31.8 ± 0.6 кг / м2 (4.0 %). Важливо зазначити, що одноразове лікування не може дати довготривалого ефекту, тому дуже важливо мотивувати пацієнток притримуватися рекомендацій щодо харчування та фізичної активності. Згідно з даними літератури адекватне зменшення маси тіла може сприяти не тільки відновленню овуляторних циклів, самостійного настання вагітності, а й підвищенню чутливості до індукторів овуляції та ефективності використання методів допоміжних репродуктивних технологій [16].
Результати нашого дослідження дозволяють зробити висновок про те, що препарат Стифімол, є ефективним засобом, що застосовується для зниження надмірної маси тіла (вірогідно знижує підвищений індекс маси тіла) в комплексі терапії порушень менструального циклу у жінок з синдромом полікістозних яєчників (СПКЯ) і може бути рекомендований для застосування в медичній практиці з метою корекції не тільки обмінних процесів, а й відновлення репродуктивного здоров’я.
Література
- Ершова Е.В. Ожирение и метаболизм / Е.В. Ершова, Г.С. Колесникова, С.А. Бутрова // Вопросы эндокринологии. – 2004. - № 1. – С. 34–37.
- Біловол О.М. Ожиріння в практиці кардіолога та ендокринолога // О.М. Біловол, О.М. Ковальова Тернопіль ТДМУ «Укрмедкнига» 2009 р. Стор.391
- Фадеенко Г.Д. Избыточный вес: проблема внешнего вида или здоровья? // Здоров’я України. - 2007. - № 7/1. - С. 45 – 56.
- Дедов И.И. Патогенетические аспекты ожирения / И.И. Дедов, Г.А. Мельниченко, Т.И. Романцова // Ожирение и метаболизм. – 2004. - № 1. – С. 3–9.
- Дедов И.И. Патогенетические аспекты ожирения / И.И. Дедов, Г.А. Мельниченко, Т.И. Романцова // Ожирение и метаболизм. – 2004. - № 1. – С. 3–9.
- Лобыкина Е.И., Хвостова О.И., Колтун В.З. Комплексный подход в коррекции избыточной массы тела и ожирения // Клиническая медицина. - 2005. - № 3. - С. 66 - 68.
- Каминский А.В. Избыточная масса тела, ожирение, метаболический синдром и их лечение //Українська медична газета. – 2007. - № 1. - С. 16 -18.
- Нікберг І.О. Як і навіщо оцінювати харчові продукти за глікемічним індексом // І.О. Нікберг / Ваше здоров’я. – 2011. - №1. – С. 34-37.
- Фадеенко Г.Д. Избыточный вес: проблема внешнего вида или здоровья? // Здоров’я України. - 2007. - № 7/1. - С. 45 – 56.
- Давыдов А.И. Роль лептина в регуляции репродуктивной системы женщины / А.И. Давыдов, М.А. Стрижаков, О.Н. Орлов // Вопросы акушерства, гинекологии и перинатологии. – 2004. - № 3 (6).- С. 84–89.
- Lloyd R.V. Leptin and leptin receptors in anterior pituitary function / R.V. Lloyd, I. Tsumanuma // J. Pituitary. – 2013. - N 1. – P. 33-47.
- Margetic S. Leptin: a review of its peripheral actions and interactions / S. Margetic, C. Gazzola, G.G. Pegg // Int J Obes Relat Metab Disord. - 2012. - N 26(11). – P. 1407–1433.
- Elmqust J.K. Leptin activates neurons in ventrobasal hypothalamus and brainstem / J.K. Elmqust, R.S. Ahima //J. Endocrinol. – 2014. - N 138 (2). – P. 839–842.
- Huang K.C. Plasma leptin is associated with insulin resistance independent of age, body mass index, fat mass, lipids, and pubertal development in nondiabetic adolescents / K.C. Huang, R.C. Lin, N. Kormas // J Obes Relat Metab Disord/ - 2013. – N 126 (3). – P. 714-719.
- Гинзбург М.М., Крюков Н.Н. Ожирение. Влияние на развитие метаболического синдрома. Профилактика и лечение. – М.: Медпрактика-М. – 2002. – 128 с.
- Cale EE, Thun MJ., Petrelli JM et al. Body-mass index and mortality in a prospective study of the US adults. N Engl Med 2009; 341: 1097–105.
- Прилепская В.Н, Цаллагова Е.В. Проблема ожирения и здоровье женщины, Акушерство и гинекология, Том 07/N 4/2005, с.34-39.
- Мкртумян А.М. Почему и как следует осуществлять коррекцию массы тела женщины без ущерба ее репродуктивной системы? Акушерство и гинекология, Том 06. - № 4. – 2004. - с.23-30.
- Davidson M. Control and risk factor reduction in obese subjects treated for 2 years / M. Davidson // JAMA. – 2009. – N 760. – P. 235–242.
- Гинзбург М.М., Крюков Н.Н. Ожирение. Влияние на развитие метаболического синдрома. Профилактика и лечение. – М.: Медпрактика-М. – 2002. – 128 с.
- Sjoestroem L. Randomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients / L. Sjoestroem, A. Rissanen, T. Andersen // Lancet. – 2011. – N 651. P. 167–172.
- Харченко Н. В., Анохина Г.А. Современные взгляды на ожирение и подходы к его лечению // Сучасна гастроентерологія. – 2002. - № 4 (10). - С. 4 – 12.
- Мурашко А.В., Кравченко Н.Ф., Грибанова Н.Д. // Гинекология. – 2007. – Т. 9, № 5. – С. 37–38.
- Клинические испытания лекарств / Под ред. В.И.Мальцева, Т.К.Ефимцевой, Ю.Б.Белоусова, В.Н.Коваленко. – 2-е изд., перераб. и доп. – К.: МОРИОН, 2006. – 456 с.
- Корпачев В.В., «Стифимол» - новый лекарственный препарат для лечения ожирения с доказанной клинической эффективностью/ Корпачев В.В., Ховака В.В./ http://www.consilium-medicum.com.ua/issues/1/6/59/






