
 Статья
Статья
 26.02.2025
26.02.2025
Современные возможности и нерешенные проблемы антитромбоцитарной терапии при ишемической болезни сердца
Л.Н. Бабий ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины
Сердечно-сосудистые заболевания (ССЗ) являются самой частой причиной смерти мужчин и женщин в большинстве стран Европы. Согласно данным Европейского общества кардиологов ежегодно от ССЗ умирают более 4 млн европейцев, из них 43% составляют мужчины, 55% — женщины, а в Украине — около 500 тыс. В то время как в США и странах Западной Европы заболеваемость и смертность от ССЗ снижаются, в Центральной и Восточной Европе эти показатели либо не снижаются, либо возрастают. Так, по данным Американской коллегии кардиологов, в США с 1995 по 2005 г. смертность от ССЗ снизилась на 26,4%. В Украине с 1995 по 2009 г. смертность от ССЗ увеличилась на 14,5% (с 875,1 тыс. до 1002,1 на 100 тыс. населения). В Украине в 2009 г. количество больных, имеющих ССЗ, составило 25,6 млн человек (56% населения). Наиболее распространены артериальная гипертензия (АГ — 11,9 млн чел.), ишемическая болезнь сердца (ИБС) — 8,7 млн чел. Ежегодно в Украине регистрируется 50,3 тыс. инфарктов миокарда (ИМ) и 105,8 тыс. инсультов [1].
Научной теорией предупреждения ССЗ, связанных с атеросклерозом, стала концепция факторов риска, сформулированная в 1960-е годы. В известном исследовании MRFIT (обследованы более 350 тыс. человек) было показано, что при отсутствии таких факторов, как курение, АГ, гиперлипидемия, риск смерти низкий — 24 человека на 10 тыс. за 5 лет. В настоящее время известно более 200 факторов риска ССЗ, среди которых: модифицируемые (дислипидемия, нарушение толерантности к глюкозе или сахарный диабет, АГ, курение, малоподвижный образ жизни, абдоминальное ожирение, злоупотребление алкоголем, низкий социальный и образовательный статус, психосоциальный стресс) и немодифицируемые: пол, возраст, отягощенный наследственный анамнез (раннее начало ИБС, у ближайших родственников — ИМ или внезапная смерть у мужчин моложе 55 лет и у женщин моложе 65 лет) [1]. По прогнозам ученых, к 2030 г. смертность от ССЗ вырастет до 24,2 млн человек.
Хотя с момента описания В.П. Образцовым и Н.Д. Стражеско в 1909 г. клинической картины тромбоза венечной артерии прошло более века, актуальность решения вопросов профилактики и лечения острого ИМ остается приоритетной задачей современной кардиологии. Острый ИМ — серьезная патология, при которой большинство пациентов умирают до оказания им медицинской помощи, а у выживших сохраняется высокий риск повторной сосудистой катастрофы — 18% мужчин и 35% женщин в течение последующих 6 лет переносят второй ИМ. Так как все чаще в такую ситуацию попадают активные люди среднего возраста, при борьбе с ИМ растет роль его вторичной профилактики.
Коварство атеротромбоза заключается в его постоянном прогрессировании и системном поражении сосудов. Больной, перенесший атеротромботический эпизод, имеет повышенный риск повторного события в том же или другом сосудистом бассейне. Например, после первого перенесенного ИМ вероятность развития второго (включая смерть) увеличивается в 5–7 раз, а мозгового инсульта — в 3–4 раза. При ишемическом инсульте риск повторного мозгового инсульта увеличивается в 9 раз, а вероятность развития ИМ — в 2–3 раза (включая внезапную смерть). Из сказанного выше следует, что в настоящее время особую актуальность и значимость приобретают вопросы профилактики и лечения ССЗ.
Исторические аспекты открытия ацетилсалициловой кислоты
Ацетилсалициловая кислота (АСК) сегодня является одним из базисных лекарственных средств, применяемых в кардиологии для лечения ИБС. В последние годы с позиций доказательной медицины выявлена польза назначения АСК для разных категорий больных, однако спектр показаний для ее назначения по-прежнему расширяется. Еще в 1828 г. Й. Бохнер сумел выделить из ивовой коры гликозид, названный им салицином (от лат. Salix — ива). В 1859 г. Герман Кольбе раскрыл химическую структуру салициловой кислоты. Впервые в чистом виде АСК была синтезирована немецким химиком-фармакологом Ф. Хоффманом в 1897 г. Примечательным является тот факт, что отец Ф. Хоффмана страдал ревматизмом и не мог передвигаться из-за выраженных болевых ощущений. Предписанный врачами для уменьшения болевого синдрома салицилат натрия плохо переносился Хоффманом-старшим, что побудило ученого искать возможности улучшения переносимости лекарственного вещества. В 1900 г. впервые на фармацевтический рынок выходит таблетированная форма АСК. Самым продаваемым препаратом АСК уже становится в 1950 г. Лишь в 1967 г. Weiss и Aledort установили, что АСК в дозе 100 мг/сут ингибирует агрегацию тромбоцитов. Понимание механизма антитромбоцитарного действия АСК стало возможным после высказанного в 1971 г. английским фармакологом J.R. Vane, работавшим в Королевском колледже хирургов в Лондоне, предположения о том, что АСК угнетает синтез простагландинов (ПГ). В 1982 г. J.R. Vane была присуждена Нобелевская премия за открытие механизма действия АСК. В дальнейшем биохимические аспекты действия АСК были уточнены, и, по современным представлениям, ацетилирование ЦОГ-1 вызывает блокирование доступа арахидоновой кислоты к активному центру этого фермента. Изначально был известен лишь жаропонижающий эффект АСК, позднее выяснились также его болеутоляющие и противовоспалительные свойства.
Механизмы действия АСК
Тромбообразование играет ключевую роль в развитии различных сердечно-сосудистых осложнений. В патогенезе ИБС значительное место занимают воспалительные и атеросклеротические повреждения сосудов с нарушением целостности интимы, замедление кровотока, дисбаланс свертывающей и противосвертывающей системы и нарушение реологических свойств крови. АСК является ингибитором циклооксигеназного пути метаболизма арахидоновой кислоты, причем средние терапевтические дозы подавляют как синтез проагреганта и вазоконстриктора тромбоксана А2, так и (что является крайне нежелательным) образование антиагреганта и вазодилататора простациклина сосудистой стенкой. Низкие дозы АСК необратимо ингибируют тромбоксансинтетазу тромбоцитов, практически не подавляя сосудистую циклооксигеназу (рис. 1).
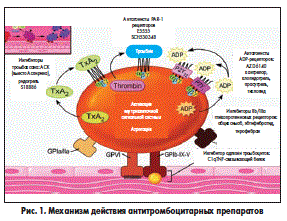
В процессе тромбообразования тромбоцит проходит четыре стадии: активация, высвобождение активных биологических веществ (тромбоксаны, аденозиндифосфат (АДФ), серотонин, гликопротеиновые (GP) рецепторы — IIb/IIIa), агрегация и адгезия. Эти процессы (макро- и микротромбообразование) особенно бурно проявляются при дестабилизации коронарного кровотока — остром коронарном синдроме (ОКС), включая ИМ. В основе макро- и микротромбообразования лежат механизмы, стимулирующие агрегационную активность тромбоцитов и эритроцитов — наличие ускоренного, турбулентного тока крови в суженном атеросклеротической бляшкой участке сосуда, что способствует повреждению эндотелия (с развитием эндотелиальной дисфункции) и «обнажению» коллагена, одного из главных факторов агрегации и адгезии тромбоцитов. Тромбоциты вступают в контакт с субэндотелиальным слоем, в частности с главным стимулятором адгезии — коллагеном, образуют отростки с образованием тромбоцитарных конгломератов (агрегация) и приклеиваются (адгезия) на этих участках, создавая белый тромб. Активация тромбоцитов осуществляется катехоламинами, тромбином, АДФ, серотонином, коллагеном, тромбоксаном А2 — продуктом метаболизма арахидоновой кислоты. В результате активации тромбоцитов происходит высвобождение из последних биологически активных веществ (АДФ, тромбоксан А2, серотонин) и лабилизация мембраны тромбоцита с образованием GP-рецепторов IIb/IIIa под действием АДФ и тромбоксана А2. Агрегация тромбоцитов — образование тромбоцитарных конгломератов в плазме крови — происходит при активации и взаимодействии GP-рецепторов IIb/IIIa через образование фибриновых мостиков между тромбоцитами (рис. 2).
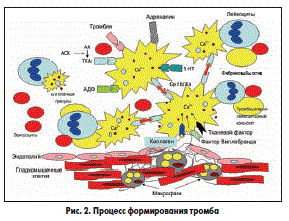
Адгезия — прилипание тромбоцитарных конгломератов к поврежденной интиме сосудов — контролируется фактором Виллебранда. АСК, подавляя образование тромбина, может ингибировать формирование фибрина, а также, блокируя путем ацетилирования остатки лизина в молекуле фибриногена, нарушает процесс превращения последнего в фибрин, что препятствует образованию тромба. При действии АСК нити фибрина утолщаются, а точнее разрыхляются, что облегчает доступ к ним активаторов плазминогена, вызывающих их растворение.
Таким образом, активация тромбоцитов — ключевой момент в патогенезе сердечно-сосудистых осложнений, во многом определяющий выраженность нарушений кровоснабжения органов и тканей (сердце, головной мозг, периферические сосуды), поэтому антиагрегационная терапия является патогенетически обоснованной. Важной особенностью действия АСК является ее способность стабилизировать поврежденную атероматозную бляшку. АСК подавляет как экспрессию генов, вовлеченных в активацию воспалительных процессов, так и активацию провоспалительных цитокинов (фактора некроза опухоли а и интерлейкина-1Р), а также нормализует уровень С-реактивного белка. АСК снижает риск первого ИМ на 56% у больных с высоким уровнем С-реактивного белка и на 14% у больных с низким уровнем. Это имеет большое значение, так как воспалительные процессы повышают риск разрыва атеросклеротических бляшек и тромбообразования. Стабильность атеросклеротической бляшки может увеличиваться и вследствие антиоксидантного действия АСК, защищающей эндотелий сосудов от продуктов перекисного окисления — свободных ОН-радикалов. АСК стимулирует продукцию ферритина, который связывает свободные радикалы железа в крови и тем самым защищает эндотелий от свободных радикалов, возникающих под влиянием свободных ионов железа. В терапевтических концентрациях АСК повышает продукцию ферритина в 5 раз. В эксперименте установлено ингибирующее влияние АСК на пролиферацию гладкомышечных клеток сосуда, что может тормозить процесс атерогенеза. АСК может регулировать (повышать) в клетках эндотелия экспрессию и активность оксида азота ^0)-синтазы, через которую реализуется ее и эндотелийпротекторное, и антиоксидантное действие. Кроме того, АСК стимулирует и/или подавляет активность разных митогенактивируемых протеинкиназ.
Несмотря на то что изначально тромбоциты рассматривали лишь как «свидетелей» процесса гемостаза, сегодня доказано, что они являются ключевыми медиаторами как тромбообразования, так и воспаления. Новое понимание клеточных и генетических уровней этих явлений, возможно, приведет к разработке новых препаратов, угнетающих функциональную активность тромбоцитов более эффективно и безопасно, чем это выполняли предшествующие лекарственные средства.
Низкие дозы АСК используются для профилактики тромбоза сосудов более 30 лет. В 1980-е годы использовались более высокие дозы препарата (до 500 мг), однако результаты многочисленных исследований доказали терапевтическую эффективность дозы от 75 до 325 мг для первичной и вторичной профилактики ССЗ. Снижение дозы препарата является условием, позволяющим обеспечить его хорошую переносимость при длительном приеме. Поскольку такие дозы АСК обладают меньшим системным действием, в частности меньше снижается торможение синтеза простагландина Е2 — протектора слизистой оболочки, ответственного за ее кровоснабжение и продукцию бикарбоната. При этом торможение агрегации тромбоцитов сохраняется при использовании низких доз АСК 100 мг/сут, так как даже низкие дозы препарата полностью (более 90%) и необратимо ингибируют циклооксигеназу 1, которая ответственна за продукцию тромбоксана из арахидоновой кислоты. Концентрация АСК в плазме крови достигает пика через 30-40 мин, а подавление функции тромбоцитов наблюдается через час после приема. При этом антитромботическое действие АСК наблюдается в интервале от 24 до 48 ч после приема, что позволяет назначать ее один раз в сутки. Несомненным достоинством АСК является ее быстрый антитромбоцитарный эффект: уже через 5 мин после внутривенного введения препарата значительно ингибируется агрегация тромбоцитов и синтез ТХА2, тем самым предотвращается цитотоксическое действие на клетки эндотелия, характеризующееся возрастанием внутриклеточного Са2+ и снижением продукции эндотелийзависимого фактора релаксации. Кроме того, не прекращаются попытки создания лекарственных форм, которые могли бы улучшить переносимость АСК. К ним относятся кишечно-растворимые формы АСК и комбинации АСК с антацидом магния гидрооксидом. Предпосылкой к созданию новых форм АСК является необходимость устранения прямого раздражающего влияния АСК на слизистую оболочку желудка, вызванную как угнетением образования простагландина Е2, так и уменьшением секреции тромбоцитарных факторов роста. Первые упоминания о препарате, который растворяется после прохождения желудка, датируются 1843 г. во французском патенте. Авторы использовали кусочки мембраны, изготовленные из кишечника овцы, которые после смачивания наносили на таблетку и подвергали сушке. Подготовленная таблетка обвязывалась тонкой нитью и скреплялась каплей желатина. Это были первые задокументированные попытки получения пероральных лекарственных форм, устойчивых к кислой среде желудка и высвобождавших активное начало в кишечнике.
Механизмы повреждения АСК включают прямое поражение слизистой, повреждение митохондрий, нарушение взаимодействия (связей) между энтероцитами, приводящее к повышению проницаемости слизистой оболочки кишечника для потенциальных патогенных факторов (бактерий и их токсинов, желчных кислот), и нейтрофильную активацию (P.J. Fortun, C.J. Hawkey, 2005). Наблюдается нарушение микроциркуляции в слизистой из-за подавления синтеза не только простагландинов, но и NO (M. Walley et al., 2003). При приеме нестероидных противовоспалительных препаратов (НПВП) пусковую роль в повреждении тонкой кишки может играть транслокация кишечной микрофлоры в слизистую оболочку (A. Lanas, C. Scarpignato, 2006). Лекарственные формы с кишечной растворимостью способны уменьшать частоту диспептических нарушений, но на риск развития язв, кровотечений и перфораций, по мнению экспертов ESC (2008), значительно не влияют.
Доказательная база применения АСК в настоящее время является одной из наиболее обширных. Согласно данным метаанализа 287 исследований, которые включали 212 тыс. пациентов с ССЗ с высоким риском сосудистых осложнений, проведенного группой экспертов Antiplatelet Trialists’ Collaboration (ATC, 2002), длительный прием антитромбоцитарных препаратов (в 2/3 случаев — АСК) снижает риск нефатального ИМ на 34%, нефатального инсульта на 25%, смертельных исходов от кардиоваскулярных причин на 15%. Согласно метаанализу АТС длительный прием АСК (75–325 мг/сут) предупреждает сердечно-сосудистые события у 36 из тысячи леченых на протяжении 2 лет после ИМ, инсульта, транзиторной ишемической атаки (ТИА), у 38 и 9 из тысячи леченых в течение месяца больных острым ИМ (ОИМ) и ишемическим инсультом и у 22 из тысячи леченых на протяжении двух лет пациентов высокого риска вследствие нестабильной стенокардии, поражений периферических сосудов, фибрилляции предсердий. В каждой из групп абсолютная польза от применения АСК значительно превышает потенциальный риск геморрагических осложнений. АСК у каждого из тысячи пациентов высокого риска сердечно-сосудистых событий предотвращает 10-20 случаев осложнений фатального или нефатального характера. Установлено, что наиболее выраженным является превентивное влияние АСК на возникновение повторного ИМ [2].
В Women’s Health Study (2005 г.) исследовали профилактическое действие АСК в низкой дозе (100 мг через сутки) в качестве первичной профилактики сердечно-сосудистых событий у 40 тыс. здоровых женщин в возрасте 45 лет и старше на протяжении 10 лет. Наиболее значимые результаты были получены в отношении снижения риска развития первого инсульта, а именно его уменьшения в общем на 17% (р=0,04), в основном за счет ишемического инсульта (на 24%, р=0,009) и ТИА (на 22%, р=0,01). Значимого увеличения числа геморрагических инсультов не выявлено. Частота желудочно-кишечных кровотечений (ЖКК) в группе АСК была схожа с группой плацебо (4,6 и 3,8% соответственно). АСК не влияет на риск фатального и нефатального ИМ, а также на смерть от сердечно-сосудистых причин в целом, однако ее применение у женщин старше 65 лет привело к статистически значимому снижению риска основных сердечно-сосудистых событий на 26%, ишемического инсульта на 30%, ИМ на 34%.
Несколько неоднозначна ситуация с применением АСК у больных АГ. Эффективность и безопасность низких доз АСК у женщин и мужчин с АГ оценивались в рамках контролируемого исследования НОТ (Hypertension Optimal Treatment) [3]. Предварительные результаты исследования, которое продолжалось 3,8 года и охватило 18 790 больных АГ, у которых на фоне антигипертензивной терапии в сравнении с плацебо оценивалась эффективность АСК в суточной дозе 75 мг, были опубликованы в 1998 г. Согласно результатам исследования НОТ частота главных сердечно-сосудистых событий и смертность от них у больных, принимавших АСК, была ниже, чем в контрольной группе. Так, риск развития острого ИМ снизился на 36%, а всех сердечно-сосудистых событий на 15%, при этом АСК не увеличивала риск фатальных кровотечений, хотя риск больших и малых кровотечений вырос в 1,8 раза. Эти данные стали основанием для рекомендаций более широкого назначения низких доз АСК больным с контролируемой АГ.
Показания к назначению АСК
Назначение АСК показано при следующих патологических состояниях:
- первичная профилактика ИБС и наличие высокого сердечно-сосудистого риска;
- стабильная и нестабильная стенокардия;
- ОИМ;
- после коронарной ангиопластики и стентирования коронарных артерий;
- после аортокоронарного шунтирования;
- острый ишемический инсульт, ТИА, нарушения мозгового кровообращения в анамнезе;
- заболевания периферических сосудов;
- ревматические пороки митрального клапана (при невозможности использовать варфарин) и состояния после операций на клапанах сердца;
- фибрилляция и/или трепетание предсердий (при невозможности использовать варфарин);
- сахарный диабет;
- АГ (после достижения контроля артериального давления);
- вторичная профилактика сосудистых событий у пациентов, перенесших ИМ или ТИА.
Противопоказания к применению АСК
Необходимо отметить, что, к сожалению, АСК не является идеальным антитромбоцитарным препаратом. Во-первых, она имеет ряд противопоказаний к использованию: применение АСК нежелательно у больных с повышенной чувствительностью к препарату, активным кровотечением, обострением язвенной болезни желудка и двенадцатиперстной кишки, с аспириновой астмой, у пациентов с заболеваниями крови (тромбоцитопеническая пурпура, гемофилия, болезнь Виллебранда, гипопротромбинемия), расслаивающей аневризмой аорты, портальной гипертензией, при почечной и печеночной недостаточности, дефиците витамина К, беременности (I и III триместр), детям до 15 лет (в связи с риском возникновения синдрома Рея), при гиперурикемии. Доказана возможность индуцирования АСК (в больших дозах) спазма коронарных артерий (так называемый синдром Kounis, или синдром аллергической стенокардии).
АСК в высоких дозах обладает противовоспалительным действием вследствие ингибирования циклооксигеназы-2 (ЦОГ-2), однако действие препарата вотношении ЦОГ-1 превышает аналогичный эффект в отношении ЦОГ-2 в 170 раз. Возникновение ЖКК при приеме АСК связано с ингибированием ЦОГ-зависимой цитопротекции вследствие снижения синтеза ПГ E2 слизистой оболочкой желудка. Риск ЖКК возрастает с увеличением дозы АСК. Так, риск кровотечений при приеме АСК в суточной дозе 75-100 мг повышается в 2 раза, а при использовании аналгезирующих и противовоспалительных доз — в 4-6 раз. Следует заметить, что для предотвращения одного летального исхода при ИМ и инсульте требуется назначить АСК 67 больным, в то же время нефатальное ЖКК выявляется только у одного из ста пациентов, которые принимали препарат. Следовательно, АСК можно считать эффективным и относительно безопасным средством вторичной профилактики ИМ и инсульта. Наибольшую опасность представляют церебральные кровотечения (геморрагический инсульт или внутричерепные кровоизлияния) и ЖКК, однако данные осложнения достаточно редки (менее 1%). Основными факторами риска развития ЖКК при длительном приеме АСК являются: предшествующий анамнез ЖКК, совместное применение НПВП, антикоагулянтов, кортикостероидов, возраст старше 60 и особенно 75 лет. В некоторых исследованиях в качестве фактора риска рассматривается также наличие Helicobacter pylori. Риск повторных ЖКК на терапию АСК у лиц с их предшествующим анамнезом составляет 15% в течение года. Более опасным осложнением при приеме АСК является ЖКК, при приеме низких доз это 2-3%. По данным метаанализа АТС, в течение 5 лет постоянного применения АСК можно ожидать три дополнительных случая серьезных ЖКК на тысячу больных. При назначении АСК необходимо учитывать абсолютный риск развития кровотечений у каждого конкретного пациента, но при высоком риске тромботических осложнений назначение АСК существенно улучшает течение заболевания, то есть выгода от лечения препаратом значительно превышает угрозу развития кровотечения.
Взаимодействие АСК с другими лекарственными препаратами
АСК не рекомендуется применять с другими НПВП из-за повышения риска ЖКК. Кроме того, считается, что некоторые НПВП (ибупрофен) снижают антитромботический эффект АСК из-за конкурентного взаимодействия за связывание с циклооксигеназой тромбоцитов. Определенная осторожность требуется при назначении АСК в комбинации с другими антитромботическими препаратами (клопидогрель, варфарин). Наряду с пользой, которую может принести такая комбинированная терапия, возрастает и риск геморрагических осложнений.
Резистентность к АСК
Аспиринорезистентность (АР) — неспособность АСК у ряда пациентов в должной мере подавлять функцию тромбоцитов, снижать синтез тромбоксана А2 и/или удлинять время кровотечения. Ее обнаруживают у 10-45% пациентов. Различают клиническую и биохимическую резистентность к АСК. Клиническая резистентность предполагает развитие острых сердечно-сосудистых катастроф на фоне приема препарата. Биохимическая резистентность — это неспособность АСК изменять агрегационную способность тромбоцитов. Механизмы резистентности к АСК до сих пор полностью не выяснены. При этом необходимо подчеркнуть, что наиболее частая причина АР — низкий комплайенс при приеме АСК. Так, было показано, что 29% пациентов после ИМ имели АР, но 57% из них не принимали регулярно АСК. Более того, только 60% пациентов, которым была назначена АСК, принимали ее. Среди возможных причин развития АР указывают на фармакодинамические взаимодействия АСК с НПВП, наличие нетромбоцитарных источников синтеза тромбоксанов А2 (эндотелий, моноцитарная/макрофагальная ЦОГ-2), экспрессию ЦОГ-2 во вновь образующихся тромбоцитах, гидролиз АСК эстеразами слизистой оболочки желудочно-кишечного тракта (ЖКТ), повышенный синтез тромбоксана А2, гиперлипидемии, курение и генетические особенности, обусловленные полиморфизмом гена ЦОГ. Также установлена связь между полиморфизмом тромбоцитов (аллель PLA GP IIIa) и резистентностью к АСК. Наличие аллеля PLA2 характеризуется большим сродством гликопротеиновых рецепторов IIb/IIIa к фибриногену, что обусловливает более сильное тромбообразование как реакцию на повреждение сосудистой стенки. Имеются сведения о связи повышения экспрессии транспортной РНК тромбоцитарной ЦОГ-2 и резистентности к АСК.
Существуют клинические ситуации, когда АСК будет не столь эффективна. Так, антитромбоцитарный эффект АСК при ИМ зависит от концентрации креатинфосфокиназы в крови: при значительном повышении уровня фермента доза АСК 100 мг/сут слабее ингибирует агрегацию тромбоцитов и синтез ТХА2, чем при средних величинах креатинфосфокиназы в крови. К сожалению, в настоящее время не существует стандартизованной методики прогнозирования эффективности АСК.
Клопидогрель
Клопидогрель и его предшественник тиклопидин относятся к тиенопиридинам, в основе действия которых лежит антагонизм к аденозин-5’-дифосфат рецепторам. Тиклопидин впервые появился в 1978 г. Эти препараты являются необратимыми ингибиторами тромбоцитов, действующими в течение всего периода их жизни. Клопидогрель отличается от тиклопидина наличием в своей структуре дополнительной карбоксиметильной группы. Он необратимо соединяется с рецептором Р2Y12, этот подтип АДФ-рецепторов связан с усилением агрегации и секреции тромбоцитов. Тиклопидин же в редких случаях приводит к нейтропении, что требует периодического контроля количества лейкоцитов для выявления и предупреждения этого потенциально опасного для жизни осложнения. Еще реже тиклопидин вызывает тромботическую тромбоцитопеническую пурпуру. Как известно, тромботическая тромбоцитопеническая пурпура в этих случаях связана с приобретенным дефицитом плазменной металлопротеазы ADAMTS13, расщепляющей фактор Виллебранда. Такие гематологические особенности привели к замене тиклопидина клопидогрелем.
Клопидогрель является пролекарством, требующим для своей активации процесса окисления в организме печеночными и/или кишечными изоферментами цитохрома P450 (CYP)3A4 и 2C19 (рис. 3). Уже в течение нескольких часов после применения препарата отмечается значительное торможение агрегации тромбоцитов. Ингибирующий эффект агрегации тромбоцитов постепенно усиливается, и стабильное состояние достигается через 3-7 дней. Несмотря на то что ингибиторы ГМГ-КоА-редуктазы (аторвастатин, флувастатин) метаболизируются теми же цитохромами, не установлено негативного влияния статинов на содержание активного метаболита клопидогреля в плазме крови и на его антиагрегантное действие.
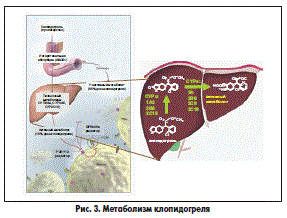
В первую очередь это относится к влиянию препарата на ЖКТ. Известно, что краткосрочный прием клопидогреля не оказывает существенного влияния на слизистую желудка. Вместе с тем тромбоциты являются источником ростовых факторов, стимулирующих ангиогенез в стенке желудка. Таким образом, клопидогрель, не оказывая прямого негативного воздействия на слизистую желудка, препятствует заживлению язв и эрозий. Соответственно, применение клопидогреля вместо АСК с точки зрения профилактики желудочных кровотечений является нецелесообразным.
Доказательная база применения клопидогреля
Результаты проведенных исследований показывают, что на фоне монотерапии клопидогрелем риск кровотечения из верхних отделов ЖКТ достаточно велик. В исследовании CAPRIE (Clopidogrel Versus Aspirin in Patients at Risk of Ischaemic Events) за период наблюдения (в среднем 1,91 года) частота желудочных кровотечений на фоне терапии клопидогрелем в дозе 75 мг/сут составила 0,52%, а при приеме АСК — 0,72% [5]. Вероятность кровотечения увеличивается при комбинированной терапии клопидогрелем и АСК. У пациентов, принимавших клопидогрель, суммарный относительный риск ишемических сосудистых событий (ИСС) (острый ишемический инсульт, ИМ и сосудистая смерть) был на 8,7% ниже, было зарегистрировано на 9,1% меньше госпитализаций, чем у принимавших АСК. Так, по данным метаанализа пяти наиболее крупных рандомизированных исследований (CURE, CREDO, CLARITY, COMMIT и CHARISMA; общее число пациентов — 79 624), частота возникновения больших кровотечений из ЖКТ у пациентов, получающих двойную антитромботическую терапию, составляет в среднем 1,6% в год. Риск геморрагий еще больше возрастает при сочетании клопидогреля с антикоагулянтами непрямого действия и является максимальным при тройной антитромботической терапии. Соответственно, у пациентов с высоким риском внутреннего кровотечения целесообразно избегать длительного использования клопидогреля. Редким, но одним из наиболее тяжелых неблагоприятных эффектов клопидогреля является развитие тромботической тромбоцитопенической пурпуры. Это фульминантное и потенциально угрожающее жизни состояние обусловлено формированием антител к металлопротеазе ADAMTS13 и проявляется тромбоцитопенией, механическим повреждением эритроцитов, почечной недостаточностью и неврологическими расстройствами. Несмотря на редкость возникновения тяжелых нарушений кроветворной системы, все пациенты нуждаются в регулярном гематологическом контроле, особенно в первые месяцы приема клопидогреля.
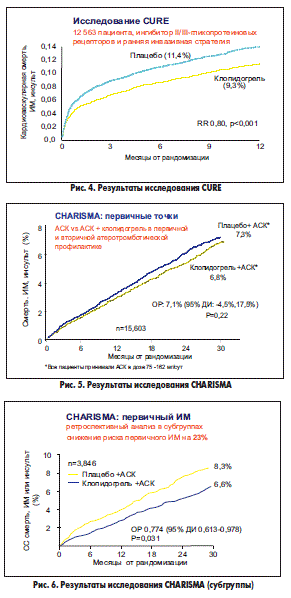
Эффективность клопидогреля при ОКС получила однозначное подтверждение в нескольких многоцентровых рандомизированных клинических испытаниях. Первым из них стало исследование CURE (Clopidogrel in Unstable angina to prevent Recurrent Events [6]), в котором приняли участие 12 562 больных с ОКС без подъема сегмента ST (рис. 4). Пациентам случайным образом назначалась терапия клопидогрелем (нагрузочная доза 300 мг, затем поддерживающая доза 75 мг/сут в течение 3-12 мес) или плацебо; кроме того, все участники исследования принимали АСК. Средняя длительность наблюдения составила 9 мес. Было установлено, что комбинированная терапия клопидогрелем и АСК позволяет снизить кумулятивный риск развития первичных комбинированных конечных точек (сердечно-сосудистая смерть + ИМ + инсульт и сердечно-сосудистая смерть + ИМ + инсульт + рефрактерная ишемия миокарда) на 20% по сравнению с монотерапией АСК. Причем эффект клопидогреля проявлялся в группах пациентов как низкого, так и среднего, и высокого риска.
В настоящее время интервенционная кардиология является одной из основных сфер применения клопидогреля. При этом в большинстве опубликованных контролируемых клинических испытаний было продемонстрировано существенное улучшение кратко- и долгосрочных исходов реваскуляризирующих процедур у пациентов с ОКС. Так, в исследовании PCI-CURE участвовали 2658 пациентов с ОКС без подъема сегмента ST, нуждавшихся в проведении ангиопластики. Все пациенты также получали АСК [7]. Суммарная частота первичной конечной точки (сердечно-сосудистой смерти, ИМ и потребности в повторной экстренной ангиопластике в течение первых 30 дней после чрескожной транслюминальной коронарной ангиопластики — ЧТКА) составила 4,5% в группе комбинированной терапии и 6,4% в группе пациентов, получавших только АСК (относительный риск 0,70; 95% доверительный интервал 0,50–0,97, p=0,03). Длительное (в течение 12 мес) применение клопидогреля после ЧТКА ассоциировалось с меньшей частотой возникновения комбинированной конечной точки (смерть от ССЗ + ИМ + любая реваскуляризация), а также со снижением относительного риска смерти и ИМ на 25% (соответственно р=0,03 и p=0,047).
Результаты исследоваия CREDO (Clopidogrel for the Reduction of Events During Observation) продемонстрировали существенную пользу от длительного применения клопидогреля после чрескожного коронарного вмешательства у больных с ОКС, что выражалось в снижении риска развития инфаркта, инсульта на 27% [8].
В исследование CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management and Avoidance), в котором участвовали пациенты с высоким риском атеротромботических осложнений (рис. 5, 6), было показано, что добавление клопидогреля в группе с инструментально подтвержденным атеросклерозом давало преимущество при всех основных локализациях атеротромботических поражений: коронарной, мозговой и периферической. Сокращение относительного риска ИСС у пациентов высокого риска составило 12,5% при р<0,05. У пациентов же с множественными факторами риска, но без подтвержденного атеросклероза АСК оказалась более эффективной в снижении смертности от всех причин [9].
В исследовании TRITON у больных с ОКС без подъема сегмента ST на электрокардиограмме, с запланированными процедурами чрескожных коронарных вмешательств терапия прасугрелем в сравнении с клопидогрелем ассоциировалась с меньшим числом сердечно-сосудистых событий, но с большим риском возникновения больших кровотечений, включая фатальные [10].
Резистентность к клопидогрелю
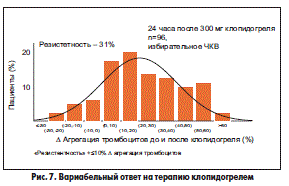
Подобно АСК при применении клопидогреля выявлена широкая индивидуальная чувствительность к препарату, то есть можно говорить о существовании резистентности не только к АСК, но и к клопидогрелю у 30% пациентов (рис. 7).
Причины резистентности к клопидогрелю следующие:
- полиморфизм рецепторов P2Y12;
- полиморфизм CYP3A4;
- увеличение высвобождения АДФ;
- альтернативные пути активации тромбоцитов.
В заключение можно констатировать, что многолетний опыт применения антитромбоцитарных препаратов для профилактики и лечения больных с атеротромбозом ставит новые задачи и побуждает исследователей к поиску более оптимального антитромбоцитарного лекарственного препарата.
В настоящее время на рынке Украины появились новые антитромбоцитарные препараты, выпускаемые отечественным производителем ПАО «Киевский витаминный завод»: препараты АСК Магникор, Магникор форте и препарат клопидогреля Атерокард.
Если говорить о препаратах Магникор, Магникор форте, это комбинация АСК и гидрооксида магния — антацида, который позволяет адсорбировать соляную кислоту, снижает протеолитическую активность желудочного сока (посредством адсорбции пепсина, повышения pH среды, в результате чего пепсин становится неактивным), обволакивает слизистую желудка, связывает лизолецитин и желчные кислоты, оказывающие негативное воздействие на слизистую желудка, то есть наличие такого гастропротекторного антацида в составе препарата Магникор позволяет минимизировать риск развития желудочно-кишечных осложнений на фоне длительного приема АСК. Наличие широкого выбора доз препарата позволяет использовать его с целью как первичной и вторичной профилактики в отношении развития сердечно-сосудистых событий, так и подбора нагрузочных терапевтических доз при ОКС.
Сегодня препараты Магникор, Магникор форте, Атерокард активно применяются в терапии различных форм ИБС, в том числе и ОКС, в отделении инфаркта миокарда и восстановительного лечения ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины.
Появление на фармацевтическом рынке качественных, доступных препаратов — Магникор, Магникор форте и клопидогреля — Атерокард позволит большинству пациентов значительно экономить средства и эффективно предотвращать развитие сердечно-сосудистых событий.
Список литературы находится в редакции «Здоровье Украины».




