
 Статья
Статья
 04.03.2025
04.03.2025
Оцінка ефективності протизапальних препаратів повільної дії у хворих на гонартроз з гіперурикемією
Н.М. Шуба1, Т.Д. Воронова1, А.С. Крилова1, О.І. Гуленко2; 1)Національна медична академія післядипломної освіти ім.. П.Л. Шупика, Київ; 2)Клінічна міська лікарня № 7, Київ
Оценка эффективности противовоспалительных препаратов длительного действия у больных гонартрозом с гиперурикемией
Н.М. Шуба, Т.Д. Воронова, А.С. Крылова, О.И. Гуленко
Национальная медицинская академия последипломного образования им. П.Л. Шупика, Киев
Резюме. В статье проведена оценка эффективности диацереина по показателям суставного синдрома, а именно ВАШ, индексов Лекена, WOMAC. Исследовано влияние диацереина на уровень цитокинов (IL-1β, TNF-α, IGF-1, TGF-β, NO), уровень мочевой кислоты, общеклинические показатели. Учитывая полученные данные, можно сделать вывод, что назначение диацереина при лечении остеоартроза уменьшает боль, улучшает качество жизни и влияет на уровень мочевой кислоты, что немаловажно при лечении больных с сопутствующей гиперурикемией.
Ключевые слова: остеоартроз, гиперурикемия, диацереин, мочевая кислота.
Остеоартроз (ОА) є однією з основних причин втрати працездатності, поступаючись при цьому лише ішемічній хворобі серця, а зростання захворюваності та його поширеності є важливою медичною, соціальною та економічною проблемою. Запалення, яке раніше вважали вторинним, на даний час розглядається як первинної події при ОА (Saxne T., Lindell M.,2003; Benito M.J., Veale D.J., 2005). Серед різних факторів, відповідальних за патогенетичні зміни та запалення в суглобі, виділяють цитокіни.
IL-1β та TNF-α є найбільш добре вивченими прозапальними цитокінами при ОА ( Stannus O. et al., 2010). Катаболічна дія IL-1β та TNF-α здійснюється через інгібування синтезу протеогліканів та колагену ІІ типу (Keny M.S., Bhounsule S.A., Rataboli P.V., 2014).
Серед анаболічних цитокінів найбільшу цікавість викликають IGF-1 та TGF-β. IGF-1 сприяє проліферації та диференціюванню хондроцитів у пошкодженому матриксі та гальмує апоптоз (Hutchison M.R., Bassett M.H., White P.C., 2007), що свідчить про його участь у процесах репарації. TGF-β регулює клітинну проліферацію, диференціювання та функціонування екстрацелюлярного матриксу ( Roberts A.B., Sporn M.B.,1993). TGF-β стимулює синтез колагену і протеогліканів та знижує діяльність металопротеаз, індукованих IL-1 (Finnson K.W., Parker W.L.,2010).
Тому в обґрунтуванні вибору лікування ОА має важливе значення нейтралізація прозапальних цитокінів та вільних радикалів на фоні стимуляції факторів росту. Серед симптоматичних препаратів повільно дії, виділяють хондроїтину сульфат-4 і -6, глюкозаміни (глюкозаміну сульфат) і діацереїн. Нещодавно проведені дослідження препаратів з цієї групи, зокрема діацереїну, показали його вплив на окремі катаболічні та анаболічні медіатори (Moldovan F.et al., 2000; Sanchez C. et al., 2003; Martin G. et al., 2003).
Пацієнти на ОА зазвичай старше 40 років, а отже мають не одне коморбідне захворювання. В зв’язку з чим, важливо враховувати вплив застосованої терапії на показники пуринового, вуглеводного, ліпідного обмінів та можливість безпечного застосування препарату у пацієнтів із супутньою патологією, зокрема гіперурикемією, яка здатна впливати на перебіг ОА.
Мета роботи: вивчити ефективність застосування діацереїну у пацієнтів на гонартроз з гіперурикемією.
Обєкт і методи дослідження
Дослідження було виконано на базі терапевтичного відділення Клінічної міської лікарні №7 м. Києва. З метою вивчення ефективності діацереїну у пацієнтів на ОА з гіперурикемією були оцінені результати дослідження за участю 54 хворих (49 жінок і 5 чоловіків), у віці від 30 до 75 років, I-III рентгенологічної стадії по Kellgren – Lawrence. Загальну характеристику обстежених хворих наведено у табл. 1.
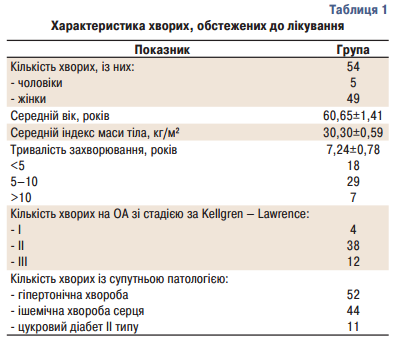
Критерії включення у дослідження:
- діагноз ОА колінних суглобів, що відповідає критеріям ACR (Altman R., 1986), EULAR (Zhang W.,2010);
- гіперурикемія (рівень сечової кислоти у сироватці крові був >360 мкмоль/л) (Hamburger M., 2011);
- чоловіки та жінки будь-якої раси, віком 35–75 років;
- до початку дослідження у пацієнтів відмічалися больові відчуття не менше 15 із 30 днів, а загальні симптоми захворювання – протягом не менше півроку;
- рентгенологічне підтвердження діагнозу ОА (стадія за Келгреном–Лоренсом І–ІІІ);
- оцінка за шкалою ВАШ 40 мм і більше при ходьбі;
- індекс Лекена від 4 балів;
- супутні захворювання: артеріальна гіпертензія І–ІІІ ступеня (систолічний АТ >140 мм рт.ст., діастолічний АТ >90 мм рт.ст.), ішемічна хвороба серця, стенокардія напруги І–ІІІ ФК, цукровий діабет 2-го типу;
- доза гіпотензивних та цукрознижуючих препаратів має бути незмінною протягом всього дослідження, тривалість прийому на момент включення у дослідження має становити не менше 3 місяців. Пацієнти, які не приймали на момент первинного огляду препаратів зазначених груп, також можуть бути включені у дослідження.
Критерії виключення:
- гіперчутливість до досліджуваного препарату;
- одночасне застосування інших хондропротекторів;
- супутні захворювання: загострення виразкової хвороби шлунку та дванадцятипалої кишки, захворювання органів кровотворення, тяжкі інфекційні захворювання, печінкова, ниркова недостатність, клінічно значимі стадії серцево-легеневої недостатності;
- наявність злоякісних новоутворень;
- недієздатність або обмежена дієздатність;
- участь у будь-якому іншому клінічному дослідженні.
Всім хворим до початку лікування та через 3 і 6 місяців терапії проводили традиційні клінічні методи дослідження, що включали збір сімейного та індивідуального анамнезу. Індекс маси тіла (ІМТ) розраховували за формулою:
ІМТ = маса тіла (кг) / зріст2 (м2).
Вираженість суглобового синдрому оцінювали за такими параметрами: біль під час руху (0−10 см за ВАШ), індекс WOMAC, індекс Лекена. Всім пацієнтам на початку спостереження проводили рентгенологічне дослідження колінних суглобів в прямій і боковій проекціях. Рентгенологічну стадію ОА визначали за класифікацією J.H. Kellgren, J.S. Lawrence (1957) (Kellgren J.H., Lawrence J.S., 1957). Всім хворим, що перебували під спостереженням, проводили загальноклінічні обстеження: загальний аналіз крові та сечі, глюкоза крові, біохімічний аналіз крові з визначенням рівнів білірубіну, аланінамінотрансферази (АлАТ), аспартатамінотрансферази (АсАТ), креатиніну, сечовини. Імунологічні дослідження включали кількісне визначення в сироватці крові рівнів IL-1β (Bender MedSystems GmbH, Австрія), IGF-1(DRG, Німеччина), TGF-β (DRG, Німеччина). Облік реакції проводили на імуноферментному аналізаторі Lab-line-100 (WestMedica, Австрія). Для аналізу стану обміну NО вивчали вміст в крові обстежених хворих рівня нітритів, як кінцевого продукту метаболізму оксиду азоту за допомогою реактиву Гріса. Визначення концентрації холестерину в крові проводили за допомогою набору реактивів «HUMAN», Німеччина, сечової кислоти –«Філіст-Діагностика», Україна.
Для статистичної обробки даних застосовували програмно-математичний комплекс для персонального комп’ютера «Microsoft Exсel 2007» (Microsoft) та комп’ютерні програми для статистичного аналізу та обробки даних «Біостатистика», «STATISTICA® 6.0» (StatSoftInc., США), «SPSS Statistics 20» (IBM, США).
Для лікування використано діацереїн (Флекцерин, ПАТ «Київський вітамінний завод») в дозі 50 мг двічі на добу протягом 6 місяців у всіх 54 пацієнтів.
Результати та їх обговорення
Оцінюючи біль за шкалою ВАШ, відмічено статистично достовірне зменшення її інтенсивності вже через 3 місяці лікування та майже вдвічі – через півроку застосування діацереїну порівняно з початковими показниками. Результати оцінки тяжкості гонартрозу за індексом Лекена свідчать про позитивну його динаміку. Так, відмічено статистично достовірне зниження альгофункціонального індексу Лекена через 3 та 6 місяців лікування (табл.2).
Розраховували індекс WOMAC, який також достовірно зменшувався. Рівень болю за WOMAC на початку склав 250,70±8,54 мм, після 3 місяців — 170,48±6,70 мм (р<0,0001) та після 6 місяців – 133,57±5,80 мм (р<0,0001). Показник обмеження рухів в суглобі вранці та протягом дня за WOMAC на початку виявився 110,00±4,48 мм, після 3 місяців — 64,72±2,27 мм (р<0,0001) та після 6 місяців – 55,20±2,21 мм (р<0,0001). Показник обмеження повсякденної активності за WOMAC на початку склав 761,43±21,75 мм, після 3 місяців — 589,98±19,81 мм (р<0,0001) та після 6 місяців – 550,80±20,34 мм (р<0,0001).
Загальна характеристика динаміки показників артрологічного статусу у пацієнтів на фоні прийому діацереїну представлена в табл. 2.
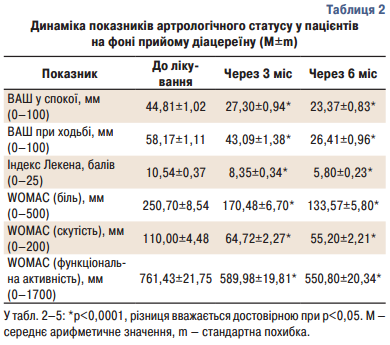
Кількість загострень захворювання в групі хворих, яким призначався діацереїн в середньому становило 4,48±0,14 за весь період спостереження. Середня тривалість днів прийому НПЗП в групі хворих за весь період спостереження склала 51,81±1,18 днів.
Наприкінці дослідження через 6 місяців лікування було отримано результати, що свідчать про статистично достовірне зниження рівня прозапальних цитокінів (TNF-α, IL-1), вільних радикалів (NO) (табл. 3), статистично достовірне підвищення рівня анаболічних цитокінів (TGF-β, IGF-1). Отримані дані демонструють властивість діацереїну знижувати інтенсивність запального процесу та підвищувати процеси регенерації у пацієнтів з гонартрозом.
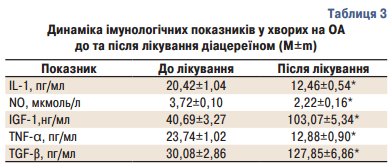
Не було відмічено динаміки показників рівня білірубіну, печінкових маркерів, холестерину, які у більшості хворих до включення у дослідження були в межах нормальних значень (табл. 4).
Рівень СРБ статистично достовірно (р<0,0001) знизився з 6,59±0,53 мг/л до 4,02±0,45 мг/л після лікування. Також статистично достовірно (р<0,0001) знизився рівень ШОЕ з 17,76±1,42 мм/год до 14,04±0,76 мм/год. Що також свідчить про протизапальний ефект діацереїну (табл. 4).
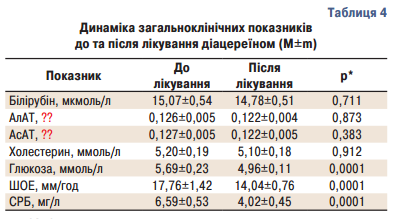
Крім того, ми спостерігали статистично достовірне (р<0,0001) зниження глюкози крові з 5,69±0,23 ммоль/л до 4,96±0,11 ммоль/л (табл. 4).
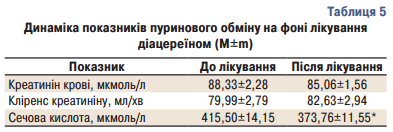
Нами також було проведено дослідження впливу діацереїну на пуриновий обмін. При оцінці показників пуринового обміну, а саме креатиніну та його кліренсу, динаміки не спостерігалось. Проте було виявлено статистично достовірне (р<0,001) зниження рівня сечової кислоти, яка до лікування була 415,50±14,15 мкмоль/л, після лікування — 373,76±11,55 мкмоль/л (табл. 5).
Висновки
- Виявлено позитивний вплив діацереїну на динаміку показників суглобового синдрому, а саме – статистично достовірне зниження вираженості болю за шкалою ВАШ, альгофункціональних індексів WOMAC і Лекена.
- При застосуванні діацереїну отримано статистично достовірне зниження рівнів прозапальних цитокінів (TNF-α, IL-1), вільних радикалів (NO), а також статистично достовірне підвищення рівнів анаболічних цитокінів (TGF-β, IGF-1). Ці дані свідчать про властивість діацереїну знижувати інтенсивність запального процесу та підвищувати процеси регенерації у пацієнтів з гонартрозом.
- Не було відмічено динаміки показників рівня білірубіну, печінкових маркерів, холестерину, креатиніну, що свідчить про безпеку застосування препарату у пацієнтів із супутньою патологією.
- При застосуванні діацереїну відмічалось зниження рівня сечової кислоти та глюкози крові.
Список використаної літератури
- Altman R., Asch E., Bloch D. et al. (1986) Development of criteria for the classification and reporting of osteoarthritis. Classification of osteoarthritis of the knee. Arthritis Rheum., Vol. 29 (8):P. 1039–1049.
- Benito M.J., Veale D.J., Fitz Gerald O. et al. (2005) Synovial tissue inflammation in early and late osteoarthritis. Ann. Rheum. Dis., Vol. 64 (9): 1263–1267.
- Finnson K.W., Parker W.L., Chi Y. et al. (2010) Endoglin differentially regulates TGF- β-induced Smad2/3 and Smad1/5 signalling and its expression correlates with extracellular matrix production and cellular differentiation state in human chondrocytes. Osteoarthritis Cartilage., Vol. 18 (11): 1518–1527.
- Hamburger M., Baraf H.S., Adamson T.C. et al. (2011) 2011 recommendations for the diagnosis and management of gout and hyperuricemia. Phys. Sportsmed., Vol. 39(4): 98–123.
- Hutchison M.R., Bassett M.H., White P.C. (2007) Insulin like growth factor I and fibroblast growth factor, but not growth hormone, affect growth plate chondrocyte proliferation. Endocrinology., Vol. 148 (7): 3122–3130.
- Kellgren J.S., Lawrence J.S. (1957) Radiologic assessment of osteoarthritis. Ann. Rheum. Dis., Vol. 16: 494- 501.
- Keny M.S., Bhounsule S.A., Rataboli P.V. (2014) Knee osteoarthritis a pathological basis for use of newer drug therapies. Int. J. Basic Clin. Pharmacol., Vol. 3 (3): 424–430.
- Martin G., Bogdanowicz P., Domagala F. et al. (2003) Rhein inhibits interleukin-l beta induced activation of MEK/ERK pathway and DNA binding of NF-kappa B and AP-I in chondrocytes cultured in hypoxia: a potential mechanism for its disease-modifying effect in osteoarthritis. Inflammation., Vol. 27 (4): 233–246.
- Moldovan F., Pelletier J.P., Jolicoeur F.C. et al. (2000) Diacerhein and rhein reduce the ICE induced IL-ip and IL-18 activation in human osteoarthritic cartilage. Osteo Cart., Vol. 8:186–196.
- Roberts A.B., Sporn M.B. (1993) Physiological actions and clinical applications of transforming growth factor beta (TGF beta). Growth Factors., Vol. 8 (1): 1–9.
- Sanchez C., Mathy-Hartert M., Deberg M.A. et al. (2003) Effects of rhein on human articular chondrocytes in alginate beads. Biochem. Pharmacol., Vol. 65 (3): 377–388.
- Saxne T., Lindell M., Maynsson B. et al. (2003) Inflammation is a feature of the disease process in early knee joint osteoarthritis. Rheumatology (Oxford)., Vol. 42 (7): 903–904.
- Stannus O., Jones G., Cicuttini F. et al. (2010) Circulating levels of IL-6 and TNF-a are associated with knee radiographic osteoarthritis and knee cartilage loss in olderadults. Osteoarthritis and Cartilage., Vol. 18: 1441–1447.
- Zhang W., Donerty M., Peat G. et al. (2010) EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis. Ann. Rheum. Dis., Vol. 69 (3): 483-489.
Стаття надана мовою оригіналу





