
 Статья
Статья
 03.03.2025
03.03.2025
Клиническая эффективность и динамика системного воспаления при использовании диацерина у пациентов с остеоартрозом; влияние ожирения
А.В. Курята, А.В. Черкасова ГУ «Днепропетровская медицинская академия»
«В то время как заболевания со смертельным исходом в основном привлекают публичное внимание, мышечно-скелетные, или ревматические, болезни, являясь основной причиной заболеваемости во всем мире, оказывая значительное воздействие на здоровье и качество жизни и нанося огромный ущерб системе здравоохранения, не столь популярны среди политических деятелей, правительств и государственных органов здравоохранения» — так подчеркнула значимость проблемы заболеваний опорно-двигательного аппарата и недостаточное внимание, уделяемое данному вопросу генеральный директор ВОЗ госпожа Гро Харлем Брундтланд, открывая рабочее совещание ВОЗ по глобальной оценке бремени болезней костно-мышечной системы (Женева, январь 2000 г.).
Остеоартроз, наряду с остеопорозом, болью в нижней части спины, ревматоидным артритом и травматическими повреждениями отнесен организацией Международной Декады Костей и Суставов (The Bone and Joint Decade 2000-2010) к заболеваниям с наиболее важным медико-социальным значением [6]. По статистике, около 10-12% населения земного шара предъявляют жалобы на боль в суставах различной локализации.
Остеоартроз (ОА) – гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими и клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондрального участка кости, синовиальной оболочки, связок, капсулы, периартикулярных мышц [2]. ОА является наиболее частым заболеванием суставов, частота которого напрямую связана с возрастом и имеет очевидные гендерные отличия: у лиц до 50 лет распространенность ОА выше у мужчин, у лиц старше 50 лет – у женщин, с превалированием ОА коленных суставов, суставов кисти и стопы. Так, максимальная распространенность ОА отмечается в группе лиц, старше 60 лет – 50%, и составляет лишь 1% у лиц до 30 лет [6]. Приблизительно у 30-40% населения в возрасте 70 лет выявляется поражение коленных суставов, при этом рентгенологические признаки ОА выявляются значительно чаще, чем клинические. Так, лишь одна треть пациентов старше 60 лет с рентгенологическими признаками ОА коленных суставов отмечает наличие клинических симптомов [8].
Учитывая прогнозы проспективных демографических исследований, число лиц старше 50 лет может удвоиться уже к 2020 г. Таким образом, становится очевидным, что заболевания опорно-двигательного аппарата занимают все больший удельный вес в структуре заболеваемости, значительно снижая уровень качества жизни пациентов в связи с наличием постоянных болей, нарушением функциональной активности, потери свободы перемещения, что отягощает не только самого больного, но и членов его семьи, и общества в целом. Именно поэтому вопросы профилактики и лечения данного заболевания приобретают особую актуальность.
ОА относится к группе заболеваний с высоким специфическим индексом счета болезней («Specific disease morbidity counts»), сочетаясь, зачастую, с 5 – 6 другими нозологиями, наиболее часто с артериальной гипертензией (52%), остеопорозом (21%), сахарным диабетом 2го типа (15%) и ожирением [1]. Многичисленные клинико-эпидемиологические исследования также продемонстрировали наличие тесной связи между хроническим болевым синдромом и психоэмоциональными нарушениями, такими как: тревога, депрессия, апатия, утомление и астения, раздражительность бессонница [5].
Последние десятилетия ознаменовались значительным прогрессом в изучении патогенеза ОА, в частности, пересмотрена позиция в отношении метаболической функции суставного хряща. Одним из ключевых медиаторов воспаления и деградации хряща является провоспалительный цитокин интерлейкин-1 (ИЛ-1), повышающий синтез целого ряда протеолитических ферментов — матриксные протеиназы, вызывающие деградацию коллагена и протеогликанов хряща. В настоящее время известно, что повышение концентрации протеогликанов, синтезируемых хондроцитами, свидетельствует о повышении функциональной активности клеток хряща, а их разрушение запускает иммунологическую воспалительную реакцию, приводящую к активации лизосомальных ферментов, вызывающих дальнейшую дегенерацию хряща [3,10]. Костное ремоделирование при ОА можно рассматривать, скорее, как вторичный процесс, возникающий в ответ на деструкцию вышележащего хряща.
Современная концепция лечения ОА направлена на уменьшение или полное купирование болей и воспаления в суставах, улучшение их функций, ограничение прогрессирования заболевания,и, как следствие, улучшение качества жизни больных. Медикаментозная терапия ОА включает два основных класса препаратов: cимптоматические препараты немедленного действия и модифицирующие препараты замедленного действия, направленные на предупреждение деградации хряща и обладающие длительным хондромодифицирующим действием [7]. Симптоматические препараты замедленного действия для лечения пациентов с ОА (англ. – SYSADOA) – генерическое название группы, включающей глюкозамин сульфат и его производные, хондроитин сульфат и диацереин. Диацереин обладает аналгетическим, антипиретическим и противовоспалительным действием, основанном на его антикатаболитическом и проанаболитическом эффектах в отношении хряща, и прописан как препарат выбора для лечения гонартроза в рекомендациях EULAR и ACR [12,13].
На сегодняшний день, клиническая эффективность и безопасность диацерина у пациентов с ОА имеет достаточно весомую доказательную базу — проведено 31 клиническое исследование (7 плацебо-контролируемых исследований, 12 — с активным контролем лекарства, 4 — плацебо-контролируемых с активным контролем лекарства и 8 — неконтролируемых) с участием более 6000 пациентов [2,4].
Особый интерес среди них представляют 2 исследования под руководством T.S. Fidelix (2006) и M. Dougados (2001) [11]. В рандомизированном многоцентровом двойном слепом плацебо-контролируемом исследовании ECHODIAH. M. Dougados и соавторы (2001) оценивали структурно-модифицирующее действие диацереина у пациентов с первичным коксартрозом (n=507). Полученные результаты продемонстрировали замедление рентгенологической прогрессии ОА в группе диацереина по сравнению с группой плацебо. В расширенной группе испытуемых разница между группами была более существенной, рентгенографическая прогрессия — 47,3% в группе диацереина по сравнению с 62,3% в плацебо-группе (р=0,007). В исследовании T.S. Fidelix и соавторов 2006), включившим 2069 участников, показан статистически значимый эффект диацерина по сравнению с плацебо. 1228 участников исследования были оценены по визуальной аналоговой шкале (ВАШ) (0–100 мм) в соответствии с чем были получены статистически значимые различия в пользу диацереина –5,16 (95% доверительный интервал –9,75; –0,57). Также было продемонстрированно статистически значимое замедление рентгенологической прогрессии сужения суставной щели у пациентов с ОА тазобедренного сустава на фоне использования диацерина[2].
Диацерин представляет собой ацетилированную форму реина с оригинальным механизмом действия, отличающего его от нестероидных противовоспалительных препаратов (НПВП). Свое действие диацерин оказывает благодаря ингибированию синтеза и активности интерлейкина-1 (IL-1), (Moldovan F. et al., 2000), IL-1-индуцируемого NO (Pelletier J.P. et al., 1998), различных свободных радикалов кислорода (Schöngen R.N. et al., 1988), продукции MMPs (Pelletier J.P. et al., 1998), апоптоза хондроцитов (Pelletier J.P. et al., 2003), стимулирует продукцию TIMPs (фактор ингибирования металлопротеаз) (Sanchez C. et al., 2003). Наряду с этим, диацерин обладает доказанными проанаболическими свойствами – стимулирует синтез факторов роста TGF-b и IGF (Felisaz N. et al., 1999), экстрацеллюлярных компонентов матрикса: протеогликанов (Yaron M. et al., 1999), аггрекана (Sanchez C. et al., 2003), гиалуроновой кислоты, коллагена II типа (Martin G. et al., 2003), даже в присутствии IL-1.
Регуляция синтеза цитокинов и их активности на фоне ингибирования свободных радикалов играет ключевую роль в сохранении хряща и восстановлении гомеостаза в суставе. Таким образом, нейтрализация цитокинов и свободных радикалов в сочетании со стимуляцией факторов роста хряща является перспективным подходом к процессу контроля за повреждением хряща при OA.
Благодаря отсутствию ингибирующего эффекта на простагландины, диацерин не обладает гастро-, кардио- и нефротоксическим действием, что позволяет использовать его в качестве противовоспалительного препарата для лечения ОА у пациентов с сопутствующей патологией и высокими рисками развития указанных побочных явлений.
Цель
Оценить клиническую эффективность препарата диацерин (флекцерин) у пациентов с ОА коленных суставов и суставов других зон (суставы кистей рук и тазобедренные суставы) и его влияние на уровень системного воспаления, потребность в НПВП, а также зависимость выраженности эффекта от наличия/отсутствия у пациента ожирения.
Материалы и методы
С целью оценки клинической эффективности препарата «Флекцерин» ПАО «Киевский витаминный завод» было проведено открытое сравнительное клиническое исследование в среди пациентов с ОА в двух параллельных группах (основная группа и группа контроля). Диагноз «остеоартроз» был установлен в соответствии с критериями ACR 1987 г, согласно приказу Министерства здравоохранения Украины от 12.10.2006 № 676 [9]. Исследование проводилось на базе отделения ревматологии Областной Днепропетровской клинической больницы им. И.И. Мечникова после получения информированного согласия, в соответствии с Хельсинской декларацией. Все пациенты (n=40), принявшие участие в исследовании случайным образом были разделены на 2 группы в соответствие со схемой лечения, сопоставимые по основным демографическим и клиническим характеристикам (табл. 1). Пациенты основной группы (n=20) в составе комплексной терапии получали препарат Флекцеринв дозе 50 мг 1 раза в день в течение первых двух недель, с последующим увеличением до 100 мг в сутки в 2 приема. Назначение НПВП допускалось по потребности самим пациентом с оценкой количества медикаментов. Пациенты группы контроля (n=20) получали только симптом-модифицирующие препараты: анальгетики и НПВП. Местная терапия на коленные суставы исключалась. Срок наблюдения составил 2 месяца. В основной группе также проводился субанализ полученных данных в зависимости от наличия ожирения и локализации поражения ОА. Распределение пациентов в зависимости от локализации ОА проводилось согласно последним рекомендациям Международного общества по изучению остеоартроза (The Osteoarthritis Research Society International, OARSI) 2014 г [14].
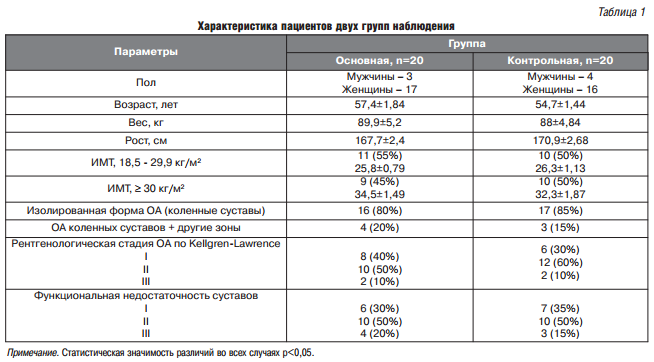
Критериями включения в исследование были: ОА I-III ст. (согласно Kellgren-Lawrence), наличие ожирения (ИМТ 29,9 — 43,6 кг/м2), возраст 40-75 лет, информированное согласие пациента
Критериями исключения из исследования были:
— ОА ІV ст.
— остеопороз I типа
— использование симптоматических препаратов замедленного действия в течение последних трех месяцев (глюкозамина сульфат, хондроитина сульфат)
— любые внутрисуставные инъекции < 6 мес
— СД І типа
— другие заболевания, сопровождающиеся костно-хрящевой резорбцией, в том числе заболевания крови
— онкологические заболевания
— гемодинамические значимые аритмии и пороки сердца
— острая кардио-васкулярная патология
— заболевания кишечника (колит, энтерит)
— СКФ ниже 60 мл/хв./1,73м2
— нарушение функции щитовидной железы (гипо-, гипертиреоз)
Клинический протокол исследования включал проведение общеклинического исследования, рентгенографии суставов с определением рентгенологической стадии заболевания. Оценка эффективности флекцерина проводилась в соответствии с общепринятыми критериями оценки препаратов при ОА: индекс WOMAC, оценка болевого синдрома в покое и при нагрузке по шкале ВАШ, потребность в НПВП, оценке эффективности лечения врачом и больным. Степень нарушения функции суставов оценивалась по опроснику HAQ-ID, степень тревоги и депрессии — шкала HADS, приверженность пациентов к лечению — опросник Мориски-Грина (табл.2).
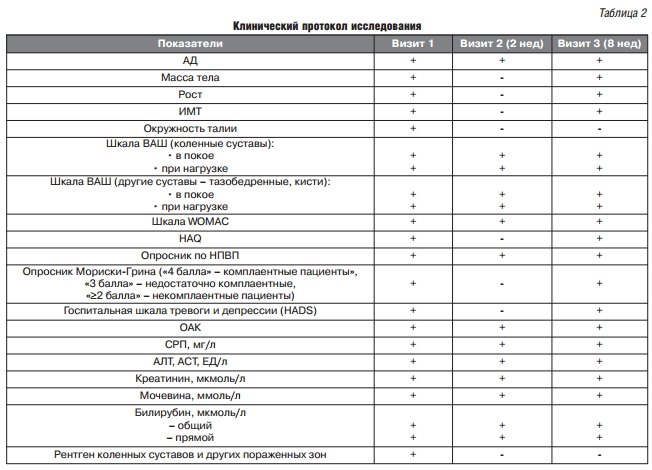
Безопасность препарата оценивалась по динамике показателей биохимического анализа крови (аланинаминотрансфераза (АлАТ), аспартатаминотрансфераза (АсАТ), щелочная фосфатаза, билирубин, креатинин, мочевина), а также жалобам, ассоциированным с побочными эффектами препаратов.
Статистический анализ проводился с помощью «Microsoft Excel 2010» (Microsoft), «STATISTICA for Windows 7.0» (StatSoft Inc., США). Количественные показатели представлены в виде n, M±m, где n – количество наблюдений, М — среднее, m — стандартное отклонение. Достоверность различий определяли с помощью t-критерия Стьюдента для непараметрических данных. Критическое значение уровня значимости (p) ≤ 0,05.
Результаты
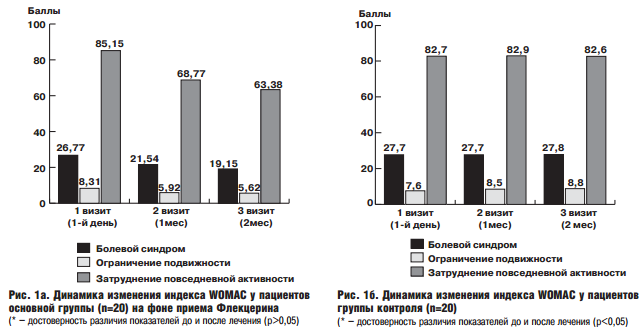
В исследовании был продемонстрирован достоверный эффект влияния терапии флекцерином на болевой синдром и функциональную подвижность суставов у пациентов с ОА. Так, в основной группе аналгетический эффект был достоверно выше, чем в группе контроля. В соответствии с индексом WOMAC, болевой синдром уменьшился на 28,5% (р < 0,05), ограничение подвижности – на 32,4% (р < 0,05), затруднение повседневной активности – на 25,6% (р < 0,05) (рис.1А). При этом, максимальное уменьшение болевого синдрома и затруднения повседневной активности наблюдалось у пациентов с генерализованным ОА, снижение ограничения подвижности – среди пациентов с ОА коленных суставов. Среди пациентов, получавших флекцерин, была оценена взаимосвязь выраженности ответа на терапию в зависимости от локализации ОА и наличия у пациентов ожирения (табл.3). Так, был продемонстрирован сопоставимый эффект в отношении уменьшения болевого синдрома, ограничения подвижности суставов и затруднения повседневной активности у пациентов с ОА коленных суставов, генерализованным ОА и сочетанием ОА с ожирением. При этом, наличие ожирения у пациентов с ОА ассоциировалось с менее выраженным ответом в отношении функциональной подвижности (ограничение подвижности и затруднение повседневной активности) по сравнению с пациентами с нормальной массой тела.
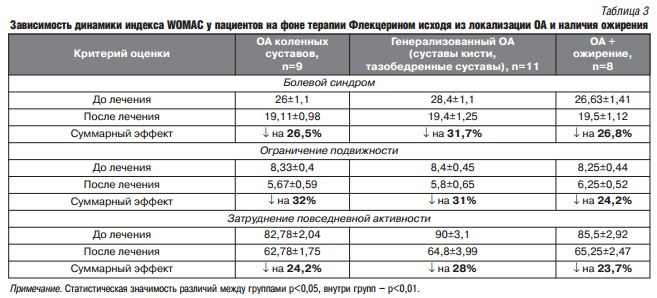
Интенсивности болевого синдрома по шкале ВАШ (боль в покое и боль при физической нагрузке) в основной группе, получающей флекцерин, продемонстрировала достоверное снижение (р < 0,05) по сравнению с исходными значениями. Так, индекс ВАШ коленных суставов в покое и при нагрузке снизилась на 28,1% и 24% соответственно, ВАШ других суставных зон в покое и при нагрузке – снизилась на 23,3% и 29,6% соответственно (табл.4).
Полученные результаты позволяют говорить о том, что аналгетический эффект флекцерина развивается уже к первому месяцу приема, в первую очередь, со стороны коленных суставов. Дальнейшее применение препарата ведет к нарастанию обезболивающего эффекта в отношении других суставных зон, уменьшению болевого синдрома при физической нагрузке, а также улучшению функционального состояния суставов. У пациентов с ОА на фоне ожирения к концу исследования, отмечено более выраженное снижение по шкале ВАШ коленных суставов в покое – 27,2% (р < 0,05) и при нагрузке – 24,4% ((р < 0,05), с некоторым отставанием эффекта по другим суставным зонам (табл.5).
При этом в группе контроля не отмечалось достоверных изменений изучаемых показателей (табл. 4).
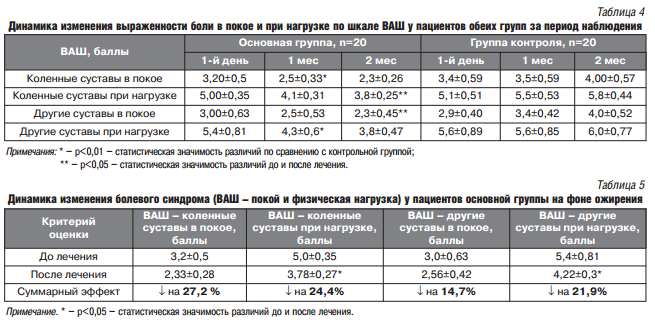
Зарегистрировано уменьшение проявлений системного воспаления к концу второго месяца наблюдения среди пациентов обеих групп наблюдения, более выраженная в группе пациентов, получавших флекцерин (рис.2). Так, к концу исследования в основной группе отмечалось достоверное снижение концентрации С-реактивного протеина (СРП) на 62,8% (р < 0,01), в контрольной — исходный показатель СРП снизился лишь на 28,4% (р < 0,01).
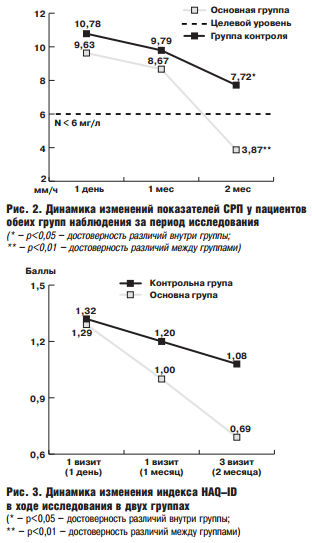
Оценка динамики улучшения функционального статуса и качества жизни по шкале HAQ – ID, продемонстрировала достоверное (р < 0,05) улучшение данного показателя по сравнению с исходными значениями (рис. 3). Так, в соответствии с полученными данными, отмечалось практически двукратное снижение значения HAQ в основной группе на фоне лечения флекцерином (с исходного 1,29 до 0,69 в конце исследования). В группе контроля динамика данного показателя была ниже – снижение на 18,2% по сравнению с исходным значением (рис.3).
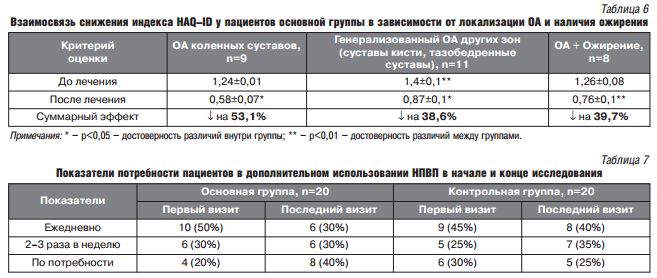
При этом, анализ внутри основной группы показал, что максимальный эффект наблюдался среди пациентов с ОА коленных суставов, по сравнению с пациентами с ОА других зон и ОА + ожирение (табл. 6).
Отмечена положительная динамика снижения потребности в дополнительном использовании НПВП среди пациентов, получающих флекцерин. Так, по сравнению с исходным использованием препаратов НПВП, количество пациентов, применявших НПВП ежедневно снизилось на 20% (табл.7).
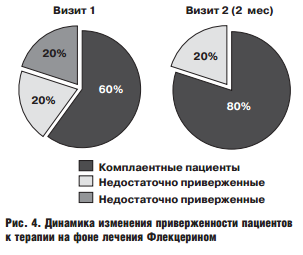
Анкетирование пациентов по опроснику Мориски-Грина (степень приверженности к терапии) в начале и конце исследования, показало положительную динамику среди пациентов, получающих флекцерин, в отношении повышения приверженности к терапии. Так, в основной группе, к концу исследования количество пациентов, приверженных к терапии увеличилось на 20% по сравнению с исходными данными. В контрольной группе, за период исследования уровень комплаентности практически не изменился (рис.4).
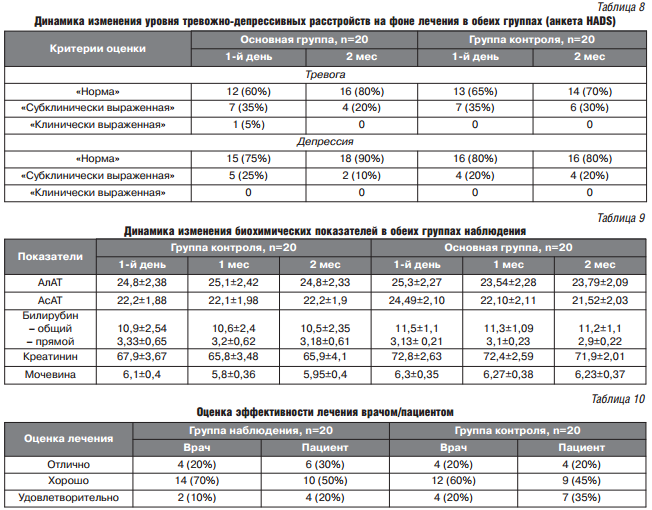
Параллельно с динамикой изменения болевого синдрома оценивался уровень тревожно-депрессивных расстройств, нередко развивающихся у пациентов с ОА на фоне хронического болевого синдрома. Так, по шкале HADS в группе пациентов, получавших флекцерин, к концу исследования зарегистрировано достоверное (р < 0,05) снижение уровня тревоги ( в 1,5 раза) и депрессии (в 2 раза) по сравнению с исходными данными. В группе контроля отмечалась некоторая положительная тенденция в снижении уровня тревоги, в то время как уровень депрессии остался неизменным (табл.8).
За период наблюдения в обеих группах не зарегистрировано каких-либо значимых изменений в показателях, оценивающих функцию печени и почек, требующих снижения дозировки препарата или его отмены (табл.9).
Среди побочных эффектов в группе пациентов, получавших флекцерин, у 2 пациентов (10%) имела место диарея, 3 (15%) – предъявляли жалобы на изжогу, 1 (5%) – на тошноту на 2й неделе лечения, 12 пациентов отмечали изменение окраски мочи на фоне проводимой терапии, о чем были предупреждены заранее; изменений в анализах мочи не выявлено. Вышеуказанные симптомы, скорее всего, были связаны с сопутствующим приемом НПВП, так как вскоре самостоятельно прошли после их отмены. В группе контроля 5 (25%) пациентов в ходе исследования предъявляли жалобы на различные проявления диспепсии (отрыжка воздухом, изжога, тошнота, боли в эпигастрии, ощущение тяжести в животе), исчезнувшие после смены НПВП или дополнительного назначения блокатора протонной помпы.
Оценивая эффект проведенного лечения, большинство пациентов как основной, так и контрольной группы расценили эффект от проведенного лечения как «хороший» (50 и 45% соответственно), что, в целом, совпало с врачебной интерпретацией эффекта проведенной терапии (табл.10).
Таким образом, в ходе исследования продемонстрирована клиническая эффективность флекцерина в отношении: уменьшения болевого синдрома (в покое и при нагрузке) и системного воспаления, улучшения функциональной подвижности суставов, что также ассоциировалось со снижением потребности в дополнительном использовании НПВП, улучшением приверженности пациентов к терапии и снижению уровня тревожно-депрессивных расстройств. При этом, как показали результаты нашего исследования, наличие ожирения у пациентов с ОА может рассматриваться как фактор, замедляющий и снижающий эффективность ответа на фармакологическое лечение ОА, подчеркивая актуальность нефармакологических методов лечения (борьба с избыточным весом), чему уделяется особое внимание в международных рекомендациях по лечению ОА.
Выводы:
- Использование диацерина (флекцерина) при ОА продемонстрировало положительную клиническую эффективность: аналгетический эффект со стороны коленных суставов развивался с первого месяца лечения с последующим улучшением функционального состояния суставов и потенциирования обезболивания в других суставных зонах. Наличие ожирения у пациентов с ОА не влияло на выраженность аналгетического эффекта со стороны коленных суставов, при лечении флекцерином. Меньшая клиническая эффективность наблюдалась при ОА со стороны тазобедренных суставов и суставов кистей рук при ожирении по сравнению с лицами с нормальной массой тела. Улучшение клинической картины ассоциировалось с достоверной позитивной динамикой психоэмоционального состояния пациентов: уменьшением уровня тревоги и депрессии.
- Использование симптоматического препарата замедленного действия «Флекцерин» обуславливало достоверное уменьшение проявлений системного воспаления (62,8 % среди пациентов, получающих флекцерин и 28,4% в группе конторля), с достижением референтного нормального уровня к концу наблюдения в группе исследования.
- При включении флекцерина в комплексную терапию ОА наблюдалось достоверное снижение количества использования НПВП, что ассоциировалось с улучшением комплаенса и характеризовалось положительной оценкой, проводимого лечения, со стороны пациента. Препарат продемонстрировал хорошую переносимость и безопасность со стороны биохимических маркеров.
Список литературы:
- А.В. Курята. Боль и проблема безопасности НПВС: монография / А.В. Курята, Т.К. Лысунец, А.В. Зайченко, А.В. Черкасова/. –Днепропетровск: «Герда». – 2014. – 84 с.
- Выбор структурно-модифицирующих и противовоспалительных препаратов у пациентов с остеоартрозом / Шуба Н.М., Воронова Т.Д., Крилова А.С. // Український ревматологічний журнал. — 2013. — №52 (2). – с. 67-71.
- Деформирующий остеоартроз: взгляд ведущих специалистов / О.Б. Яременко, А.А. Бурьянов, И.А. Палиенко // Здоров’я України. — 2015. — №6. – с. 54-55.
- Клиническая эффективность медленнодействующих препаратов у больных с деформирующим остеоартрозом / Беловол А.Н., Князькова И.И // Здоровья Украины. – 2008. — Т. 11, № 1. — С. 89–92.
- Курята О.В. Хронічний больовий синдром при запальних захворюваннях суглобів: методичні рекомендації / О.В. Курята, Т.К. Лисунець, О. Ю. Нода — Дніпропетровськ: Акцент ПП. – 2012. – с.34 (полностью)
- Лечение боли у больных с остеоартрозом различной локализации / Н.В. Чичасова. // Лечащий врач. — №7. – 2014.
- Остеоартроз: современные принципы лечения /Поворознюк В.В. //Здоровье Украины. – 2003 (ноябрь).
- Остеоартроз и проблема хронической боли в терапевтической практике / В.Ю. Приходько //Український медичний часопис. — III/IV 2012. — №2 (88). — с.64-69.
- Про затвердження протоколів надання медичної допомоги за спеціальністю «Ревматологія»: Наказ Міністерства охорони здоров’я України № 676 від 12.10.2006.
- Роль интерлейкина 1 при остеоартрозе и возможности его блокировани / Балабанова Р. М. // Современная ревматология. — 2011. — № 1. — С. 58–62
- Burkhard F. Leeb. Clinical Efficacy and Safety of Diacerein in Osteoarthritis — A Review // European Musculoskeletal Review. – 2010. — 5 (1). –р. 23–29
- Fernandes L., Hagen K. B., Bijlsma J. W., Andreassen O., Christensen P., Conaghan P. G. et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis // Ann Rheum Dis. 2013; 72: 1125–1135.
- Jordan K. M., Arden N. K., Doherty M. EULAR recommendations 2003: an evidence based approach to the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Ann Rheum Dis. – 2003. – 62. –р. 1145–1155.
- McAlindon T. E., Bannuru R. R., Sullivan M. C., Arden N. K., Berenbaum F., Bierma-Zeinstra S. M. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis // Osteoarthritis Cartilage. 2014; 22: 363–388





