
 Статья
Статья
 26.02.2025
26.02.2025
Оценка терапевтической эквивалентности лекарcтвенного средства Плестазол ПАО «Киевский витаминный завод» (Украина), референтному лекарственному средству Плетал, производства фирмы «Otsuka Pharmaceutical Co., Ltd.» (Япония) в лечении больных с перемежающей хромотой
Ю.В. Родин, Н.В. Яснопольская ГУ «Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины»
Реферат В статье представлены результаты рандомизированного сравнительного исследования. Целью которого была оценка терапевтической эквивалентности по показателям эффектив¬ности лекарcтвенного средства Плестазол, производства ПАО «Киевский витаминный завод» (Украина), референтному лекарственному средству Плетал, производства фирмы «Otsuka Pharmaceutical Co., Ltd.» (Япония), в лечении перемежающей хромоты у пациентов с облитерирующими заболеваниями артерий нижних конечностей.
Ключевые слова: облитерирующий атеросклероз сосудов нижних конечностей, перемежающая хромота, цилостазол.
Облитерирующие заболевания артерий нижних конечностей (ОЗАНК) за последние десятилетия достигли поистине эпидемической распространенности. Так по данным N.W. Shamans 2007 [7], они встречаются у 12-14% населения, а в возрасте старше 75 лет – у 20%. На ранних стадиях, основным симптомом заболевания, является «перемежающая» хромота (ПХ). Согласно данных Трансатлантического междисциплинарного консенсуса по лечению больных с ОЗАНК (TASC-PAD-II,2007), ПХ встречается у 3% людей старше 40 лет и у 6% — старше 60 лет [6]. Наиболее частой причиной развития ОЗАНК, без сомнения является атеросклероз — 90%, значительно реже – облитерирующий эндартериит 0,5-5,6% в европейских странах и менее 1% приходится на болезнь/синдром Рейно [1,9]. Целью лечения больных с ОЗАНК, является во первых, уменьшение летальности данной группы пациентов, так как это группа больных высокого сердечено-сосудистого риска. Во вторых, улучшение качества жизни, связанное с коррекцией симптомов заболевания, в частности ПХ. Согласно рекомендациям TASC-II, доказали свою эффективность два направления лечения больных с симптомами ПХ:
- Лечебная физкультура, в виде дозированной ходьбы, которая включает в себя ежедневные тренировки на тредмиле.
- Медикаментозная коррекция симптомов перемежающей хромоты, основанная на приеме препаратов, улучшающих коллатеральное кровообращение в конечности.
По данным проведенного глубокого метаанализа рандомизированных исследований, была доказана эффективность только двух препаратов в лечении ПХ: нафтидрофурил и цилостазол (ЦС). Эти препараты показали объективное увеличение дистанции безболевой ходьбы и были рекомендованы как FDA, так и вышеуказанным конценсусом (степень доказательности А) [6].
Применение лечебной физкультуры, в виде тренировок на тредмиле, или ежедневной дозированной ходьбы, то это простой, доступный и достаточно эффективный способ лечения. Что касается медикаментозной коррекции ПХ, то на сегодняшний день существует и активно используется целый ряд препаратов, среди которых: пентоксифиллин, простагландин Е1, нафтидрофурил, берапрост. Не смотря на это, препаратом выбора для лечения больных с ПХ, является Цилостазол [2,3,7].
Цилостазол (cilostazol) –ингибитор фосффодиэстеразы III, который способствует увеличению содержания цАМФ в гладкомышечных клетках сосудов, эндотелия и тромбоцитах, за счет чего реализуются его основные фармакологические эффекты. К таковым относятся: антитромбоцитарная активность, за счет уменьшения агреганции тромбоцитов, периферическая вазодилятация и защита эндотелия за счет увеличения синтеза оксида азота, торможение пролиферации гладкомышечных клеток в стенке сосуда, а так же доказанные в экперименте, уменьшение уровня триглицеридов (ТГ) и повышение уровня HDL – холестерина [4,5]. До настоящего времени возможность применение Цилостазола в Украине в течение длительного времени было невозможным, ввиду отсутствия данного препарата на рынке Украины.
Материалы и методы
На базе отдела неотложной и восстановительной сосудистой хирургии ГУ «Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины» было проведено клиническое рандомизированное сравнительное, па¬раллельное в двух группах исследование, целью которого была оценка терапевтической эквивалентности по показателям эффектив¬ности лекарcтвенного средства Плестазол, таблетки, по 100 мг, производства ПАО «Киевский витаминный завод» (Украина), референтному лекарственному средству Плетал, таблетки, по 100мг, производства фирмы «Otsuka Pharmaceutical Co., Ltd.» (Япония), в лечении пациентов с ОЗАНК и степенью хронической артериальной недостаточностью (ХАН) IIА степени. Задачами данного исследования было:
- изучить терапевтическую эффективность исследуемых препаратов в лечении пациентов с облитерирующими заболеваниями сосудов нижних конечностей и ХАН II А степени;
- изучить переносимость и возможные побочные реакции исследуемых препаратов;
- сравнить эффективность лечения в основной и контрольной группах и оценить терапевтическую эквивалентность исследуемого препарата препарату сравнения.
В исследовании приняли участие 78 пациентов, находящихся на амбулаторном или стационарном лечении в отделе неотложной и восстановительной хирургии. Все пациенты были распределены на две группы – основную и контрольную. Пациенты основной группы получали исследуемое лекарственное средство Плестазол, таблетки, по 100 мг, производства ПАО «Киевский витаминный завод». Препарат назначали по 100 мг в сутки) в течение 10 недель. Референтное лекарственное средство Плетал, таблетки, по 100 мг, производства фирмы «Otsuka Pharmaceutical Co., Ltd.» (Япония), назначали пациентам контрольной группы.
В основную группу вошли 37 мужчин и 2 женщины, группу контроля составили 31 мужчина и 8 женщин (таб.1). Возраст больных основной группы колебался от 42 до 65 лет, средний возраст составил 53,4±5,9 лет, группы контроля от 32 до 65 лет, средний возраст 51,2±6,8 лет. Распределение больных по возрасту и полу были идентичны. Из сопутствующих заболеваний у пациентов обеих групп преобладала гипертоническая болезнь ІІ стадии – 46 (59%), ИБС – 25 (3,2%), сердечная недостаточность – 25 (3,2%), и атеросклеротический кардиосклероз – 26 (33,3%). В исследование не включали пациентов с тахикардией, нестабильной стенокардией, перенесших инфаркт миокарда, а также пациентов, которые принимали антиагрегантные и антикоагулянтные средств. Так как дистанция безболевой ходьбы у пациентов с ОЗАНК является определяющим критерием стадии заболевания и эффективности лечения, всем больным производили измерение исходной дистанции ходьбы. Данные представлены в таб.1 и 2.
Таблица 1 — Анализ однородности групп по дистанции безболевой ходьбы
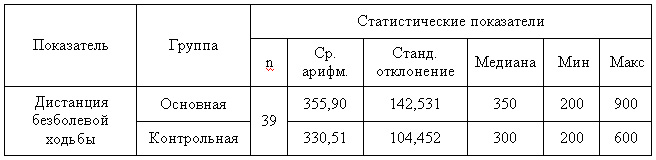
Таблица 2 — Сравнение групп по дистанции безболевой ходьбы при помощи критерия Манна — Уитни
![]()
.jpg)
Результаты лечения пациентов анализировали на начальных и конечных точках наблюдения от начала приема сравниваемых препаратов. Оценивали субъективные изменения в состоянии пациентов путем анкетирования больных, оценки динамики изменения дистанции безболевой ходьбы. Кроме того подвергалась оценке переносимость препарата на основании объективных данных полученных в ходе проведения исследования. С этой целью на каждом визите производился объективный осмотр больных, включающий измерение частоты сердечных сокращений (ЧСС), аускультацию сердца и легких. осмотр кожи и видимых слизистых, оценка основных лабораторных показателей (ОАК, ОАМ, биохимические показатели). При этом любое, клинически значимое негативное проявление рассматривалось как побочное явление, если оно не было вызвано естественным течением заболевания или ожидаемым эффектом от применения сопутствующей терапии. До начала исследования, всем пациентам выполнялись инструментальные методы исследования. Ультразвуковая допплерография (УЗДГ) с измерением плече-лодыжечного индекса (ПЛИ), ЛДФ.
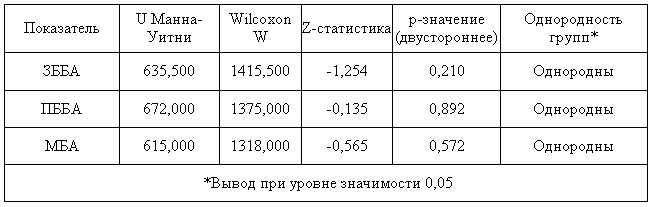
Анализ однородности групп по ПЛИ представлен в таб.3.
Таб.3. Анализ однородности групп по показателям плече-лодыжечного индекса при помощи критерия Манна — Уитни
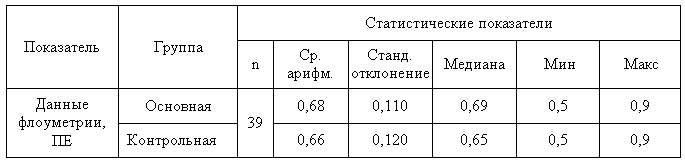
Учитывая тот факт, что при ОЗАНК имеет место снижение перфузии кожи, которое коррелирует с величиной регионарного систолического давления, в связи с этим, всем больным, которые вошли в исследование, выполнялась ЛДФ. Величина перфузии кожи составила в среднем 0,67±0,02. Результаты анализа данных ЛДФ в группах приведены в таб.4 и 5.
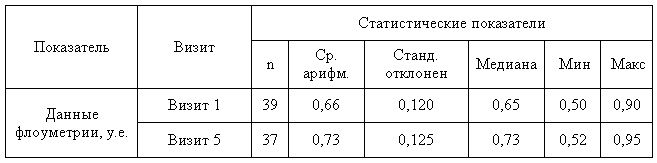
Таб.4 — Анализ однородности групп по данным флоуметрии ПЕ
Таб. 5.— Анализ однородности групп по данным флоуметрии при помощи критерия Стьюдента для независимых выборок

Основываясь на результатах анализа (табл.4 и 5), можно сделать вывод, что изначально группы статистически значимо не различались по данным УЗДГ (ПЛИ) и ЛДФ.
Таким образом, анализируя исходные данные, характеризующие пациентов, включенных в данное исследование, можно сделать вывод, что изначально группы по основным параметрам статистически были сопоставимы. Регистрация данных обследования пациентов проводилась по пяти контрольным точкам, соответственно 1 точка наблюдения – начальная, 2 – 1 неделя исследования, 3 – 3, 4 — 5 неделя, 5 – 10 неделя.
Результаты и их обсуждение
Оценка эффективности исследуемого препарата была проведена на основании проведенных исследований: препарат считался эффективен при увеличении лимитирующей дистанции ходьбы на 50 и более метров; увеличении объемного кровотока на 10% и более; увеличении уровня напряжения кислорода в ткани пораженной конечности на 10 мм.рт.ст. Препарат считался не эффективен при: увеличении лимитирующей дистанции ходьбы менее, чем на 50 м; увеличении объемного кровотока менее, чем 10%; увеличении уровня напряжения кислорода в ткани пораженной конечности менее, чем на 5 мм.рт.ст.
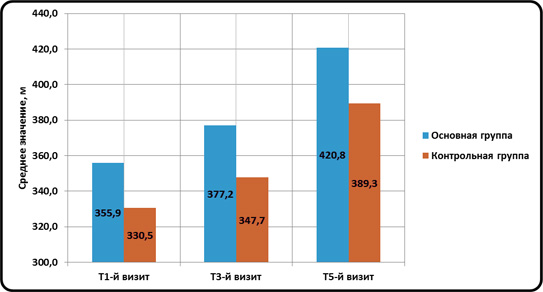
Переносимость лекарственного средства оценивалась по разработанной шкале эффективности и была распределена на: хорошую переносимость, удовлетворительную и неудовлетворительную. Из 78 пациентов рандомизированных, полностью завершили курс лечения и были обследованы в объеме, предусмотреном протоколом 36 (92,3%) пациентов основной группы и 37 (95%) пациентов контрольной группы. Из них, 3 (3,8%) больным потребовалась отмена препарата по причине «неудовлетворительной» переносимости, а 2 (2,6%) больных не явились на заключительный визит не объясняя причины. В обеих группах наблюдалось статистически значимое увеличение дистанции безболевой ходьбы начиная с 3 недели терапии. Анализ динамики дистанции лимитирующей ходьбы в группах наблюдения представлен на Рис. 1.
Графически динамика средних значений дистанции лимитирующей ходьбы Рис.1.
На основании данных дистанции ходьбы (для 1-ой и 4-й, и 5-й точек наблюдения) создана дихотомическая переменная с категориями — «увеличение лимитирующей дистанции ходьбы на 50 и более метров» «увеличение лимитирующей дистанции ходьбы менее, чем на 50 м». Показатели описательной статистики (частоту и долю в процентах) для этой переменной приведены в табл.6.
Таблица 6 — Оценка дистанции безболевой ходьбы в группах
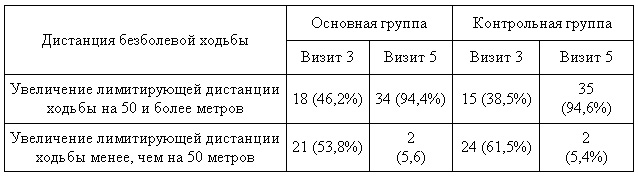
Также выполнялось сравнение доли для точки наблюдения 1, точки наблюдения 4 и точки наблюдения 5 в каждой группе посредством критерия Мак-Нимара (см. табл.7). Видно, что в обеих группах происходит статистически значимое увеличение дистанции безболевой ходьбы.
Таблица 7 — Оценка дистанции безболевой ходьбы в группах при помощи критерия Мак-Нимара
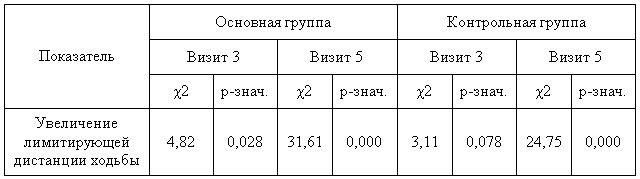
Что же касается результатов объективных методов исследования, то по данным УЗДГ в обеих группах больных, отмечалось статистически значимое увеличение ПЛИ (таб.8).
Таблица 8 — Результаты сравнение при помощи критерия знаковых рангов Уилкоксона показателей плече-лодыжечного индекса для каждой группы
Анализ динамики перфузии кожи по данным лазерной допплеровской флоуметрии в группах наблюдения методами описательной статистики до и после лечения представлен в табл. 9-10.
Таблица 9 — Динамика данных флоуметрии в основной группе
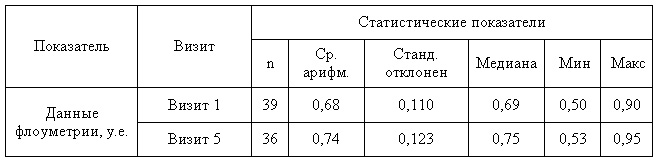
Таблица 10 — Динамика данных флоуметрии в контрольной группе
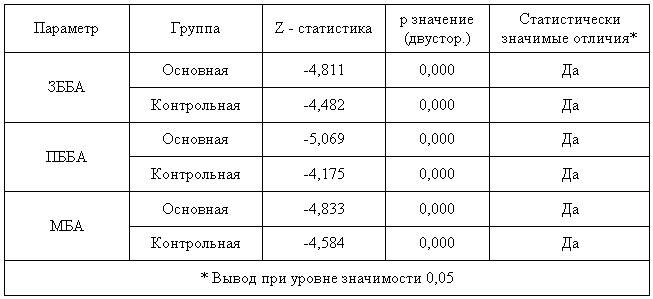
Так как индивидуальные разности не распределены нормально в обеих группах, то сравнение значений для Твизит1 и Твизит5 выполнялось при помощи критерия знаковых рангов Уилкоксона (см. табл.11).
Таблица 11 — Результаты сравнение при помощи критерия знаковых рангов Уилкоксона данных флоуметрии для каждой группы
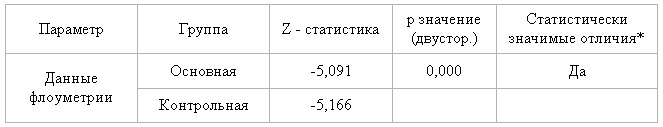
Таким образом, в обеих группах присутствует статистически значимая положительная динамика данных флоуметрии.
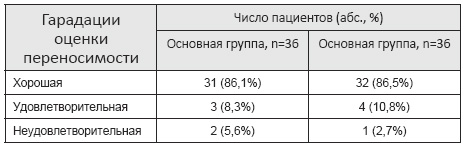
За время исследования проводилась оценка жалоб, возникающих у пациентов, которых не было ранее. Среди основных жалоб, пациенты выделяли появление головной боли – 3 (4,1%), тошноту — 1(1,4%), подъем артериального давления — 2 (3%), головокружение – 1 (1,4%), шум в ушах – 1(1,4%), а так же явления ринита – 1 (1,4%). В случае, когда появившиеся жалобы были купированы и это не потребовало отмены препарата, переносимость расценивалась как «удовлетворительная». 3 (4%) больным требовалась отмена препарата по причине «неудовлетворительной» переносимости, из них у 2 (5,6%) больных основной группы и у 1 (2,7%) – группы контроля. У 2 больных отмена препарата была необходимой по причине выраженного цефалгического синдрома, не купируемого приемом аналгетиков. Это были пациенты из основной и контрольной групп в равном количестве. У 1 пациента из основной группы прекращение приема препарата связана с тошнотой. Переносимость препарата по группам представлена в таб.12. «Хорошая» переносимость препарата была у 62 (79,5%) исследуемых, из них у 31 (86,1%) основной группы и 32 (86,5%) – группы контроля. Переносимость расценена как «удовлетворительная» у 7 (9%): 3 (8,3%) и 4 (10,8%) соответственно по группам.
Таблица 12 — Оценка переносимости исследуемыми препаратами
Выводы:
- Лекарственное средство Плестазол, таблетки, по 100 мг, производства ПАО «Киевский витаминный завод» обладает высокой эффективностью в лечении больных с облитерирующим заболеванием артерий нижних конечностей ХАН IIА стадии
- Лекарственное средство Плестазол, таблетки, по 100 мг, производства ПАО «Киевский витаминный завод» хорошо переносится больными, не вызывает серьезных побочных явлений и негативных изменений лабораторных показателей
- Результаты проведенного исследования показали, что лекарственное средство Плестазол, таблетки, по 100 мг, производства ПАО «Киевский витаминный завод» является терапевтически эквивалентным препарату Плетал, таблетки, по 100мг производства фирмы «Otsuka Pharmaceutical Co., Ltd.» (Япония) по терапевтической эффективности и безопасности.
Список используемой литературы:
- Arkkila P.E. Thromboangiitis obliterans (Buerger`s disease). Orphanet J Rare Dis. 2006 Apr 27:1:1:4.
- Brossa M., Garcia-Cases C., Clerch L., March J.R., Lozano F.S. Cost-effectiveness analysis of cilostazol vs naftidrofuryl and pentoxifilline for the treatment of intermittent claudication in Spain // Angiologia. 2011; 63(3):103-7.
- Dawson D.L., Cutler B.S., Hiatt W.R. A comparison of cilostazol and pentoxifylline for treating intermittent claudication // Am J Med. 2000;109:523–30.
- Lee T.M., Su S.F., Hwang J.J., Tseng C.D., Chen M.F., Lee Y.T., Wang S.S.Differential lipogenic effects of cilostazol and pentoxifylline in patients with intermittent claudication: potential role for interleukin-6 // Atherosclerosis. 2001 Oct; 158(2):471-6.
- Manickavasagam S., Ye Y., Lin Y., Perez-Polo R.J., Huang M.H., Lui C.Y., Hughes M.G., McAdoo D.J., Uretsky B.F., Birnbaum Y. The cardioprotective effect of a statin and cilostazol combination: relationship to Akt and endothelial nitric oxide synthase activation // Cardiovasc Drugs Ther. 2007 Oct; 21(5):321-30.
- Norgren L., Hiatt W.R., Dormandy J.A. et al. On bahalf of the TASC II Working group. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II) // J vasc Surg. – 2007. – Suppl.1. – P.5-67.
- Regensteiner J.G., Ware J.E. Jr, McCarthy W.J., Zhang P., Forbes W.P., Heckman J., Hiatt W.R. Effect of cilostazol on treadmill walking, community-based walking ability, and health-related quality of life in patients with intermittent claudication due to peripheral arterial disease: meta-analysis of six randomized controlled trials // J Am Geriatr Soc. 2002 Dec; 50(12):1939-46.
- Shamas N.W. Epidemiology, classification, and modifiable risk factor of peripheral arterial disease. Vase Health Risk Manag. 2007 June; 3(2): 229- 234.
- Zeni S, Ingegnoli F. Raynaud`s phenomenon. Reumatismo 2004 Apr-June; 56(2): 77-81.





