bead-crumps

 Article
Article
 02.02.2025
02.02.2025
Вплив омега-3 поліненасичених жирних кислот на показники ліпідного спектра крові, динаміку рівня лептину та функцію ендотелію у хворих на ішемічну хворобу серця у поєднанні з неалкогольним стеатозом печінки
О.В. Курята, М.М. Гречаник ДЗ «Дніпропетровська медична академія МОЗ України»
Мета дослідження: вивчення впливу омега-3 поліненасичених незамінних жирних кислот (ПНЖК) на рівень лептину, показники ліпідного спектра крові та функції ендотелію у хворих на ішемічну хворобу серця (ІХС) у поєднанні з неалкогольним стеатозом печінки.
Матеріали та методи. У дослідженні взяли участь 44 чоловіки. У групу А (основну) увійшли 24 хворих віком 55-72 років (медіана — 64 [59,0; 69,0] роки) на ІХС у поєднанні з неалкогольним стеатозом печінки. У групу В (порівняння) – 18 хворих віком 53-70 років (медіана — 59,7 [56,0; 65,0] роки) на ІХС без неалкогольного стеатозу. Усім хворим визначали показники ліпідного спектра крові, рівень лептину та функціональний стан ендотелію судин.
Висновки. Використання у лікуванні хворих на ішемічну хворобу серця (ІХС) у поєднанні зі стеатозом печінки препаратів омега-3 поліненасичених незамінних жирних кислот (ПНЖК) в якості вторинної профілактики забезпечує зниження рівня ТГ, ЛПДНЩ, лептину та підвищення рівня ЛПВЩ. Виявлена позитивна динаміка показника функції ендотелію та рівня ІХС та тенденція до зменшення показників рівня глюкози крові, що свідчить про наявність плейотроптних ефектів омега-3 ПНЖК.
Ключові слова: ішемічна хвороба серця, неалкогольний стеатоз печінки, ліпідний спектр, рівень лептину, ендотеліальна дисфункція, омега-3 поліненасичені незамінні жирні кислоти.
Серцево-судинні захворювання (ССЗ), особливо ішемічна хвороба серця (ІХС), залишаються найчастішою причиною смерті в усьому світі, особливо у хворих із супутньою патологією печінки, а саме неалкогольним стеатозом [2, 3, 6]. На сьогодні виявлено безліч доведених і ймовірних маркерів ризику, пов’язаних із серцево-судинними захворюваннями, включаючи куріння, підвищений рівень глюкози, гіпертонію, гіперліпідемію, ожиріння [13]. Особливістю ліпідного спектра у хворих на ІХС у поєднанні з неалкогольним стеатозом є підвищення рівня тригліцеридів (ТГ) [1] та холестерину ліпопротеїнів низької щильності (ЛПНЩ) і зниження рівня холестеринуліпопротеїнів високої щільності (ЛПВЩ).
Під час дослідження було встановлено, що високий рівень ТГ (>1,7 ммоль/л) незалежно пов’язаний з підвищеним ризиком серцево-судинних захворювань (ССЗ) [7, 2], хоча у відповідності з Європейськими рекомендаціями з лікування дисліпідемій (2016 р.) [8] терапія, направлена на корекцію гіпертригліцеридемії, повинна розпочинатися з рівня ТГ >2,3 ммоль/л. Відомо, що статини насамперед націлені на підвищений рівень ЛПНЩ і мають менш виражений вплив на рівень ТГ. Проте існує низка побічних ефектів статинотерапії у формі підвищення рівня печінкових трансаміназ, міастенічного компоненту, рабдоміолізу, що обмежує їхнє використання у хворих на ІХС у поєднанні з неалкогольним стеатозом. У Європейських рекомендацій з лікування дисліпідемій (2016 р.) та Європейських рекомендацій з профілактики серцево-судинних захворювань [12] питання корекції дисліпідемії у даної групи хворих не визначено.
Зі свого боку лептин відіграє значну роль у регуляції енергетичного гомеостазу, нейроендокринної функції та метаболізму і на сьогодні викликає великий інтерес вчених. За результатами великого проспективного дослідження встановлено, що лептин є новим незалежним чинником ризику розвитку ІХС [15], пов’язаний з інфарктом міокарда та інсультом у чоловіків і жінок незалежно від інших факторів ризику серцево-судинних захворювань і стану ожиріння [16]. З іншого боку, недавнє проспективне дослідження і систематичний огляд показали, що між рівнями лептину та ризиком ІХС після коригування ІМТ статистично значущої асоціації не спостерігалося [13]. За результатами мета-аналізу був ідентифікований значний зв’язок рівня лептину з ІХС. Крім того, ризик ІХС збільшувався на 4% з кожною додатковою одиницею рівня лептину [16]. Отже, питання корекції дисліпідемії у хворих на ІХС у поєднанні з неалкогольним стеатозом печінки, а також вплив рівня лептину на прогресування серцево-судинних захворювань залишається невирішеним і дискутабельним.
На сьогодні омега-3 поліненасичені незамінні жирні кислоти (ПНЖК) і, зокрема, ейкозапентаєнова кислота і доко- загексаєнова кислота, володіють декількома метаболічними і фармакологічними ефектами, потенційно корисними для профілактики або лікування великої кількості хронічних захворювань людини [9]. Омега-3 ПНЖК не впливають на функцію печінки [5]. За результатами двох подвійних сліпих плацебо-контрольованих досліджень Harris та Pownall спостерігалося значне зниження рівня ТГ і загального рівня холестерину (ЗХС) та значне збільшення рівня ЛПВЩ, які були статистично значущими порівняно з плацебо (Harris: 32%; p=0,0014, Pownall: 16,7%; p=0,013) [14]. Також було показано, що омега-3 ПНЖК мають низку плейотропних ефектів, а саме значно зменшують кількість запальних маркерів, пов’язаних з атеросклерозом і серцево-судинними захворюваннями [11]. У дослідженні DART (Diet and Reinfarction Trial) продемонстровано зниження смертності від усіх причин у чоловіків з інфарктом міокарда (ІМ) в анамнезі на 29% за 2 роки спостереження під час вживання омега-3 ПНЖК. Результати дослідження Indian Experiment of Infarct Survival констатували зниження кардіоваскулярної смертності на 50%, частоти нефатального ІМ — на 48%, усіх кардіологічних епізодів — на 40% на тлі застосування омега-3 ПНЖК [4].
Незважаючи на запропоновані кардіопротекторні механізми, на сьогодні ефекти впливу омега-3 ПНЖК на серцево-судинні події ще не визначені у великомасштабних клінічних випробуваннях [5] і потребують подальшого вивчення, що стало приводом для використання Омега-3 ПНЖК (ейкозапентаєно- ва кислота — ЕПК і докозагексаєнова кислота — ДГК) у формі лікарського засобу Епадол НЕО виробництва АТ «Київський вітамінний завод» (Україна) у дозі 2000 мг на добу у хворих на ІХС у поєднанні з неалкогольним стеатозом печінки.
Мета дослідження: вивчення впливу омега-3 ПНЖК на рівень лептину, показники ліпідного спектра крові та функції ендотелію у хворих на ІХС серця у поєднанні з неалкоголь- ним стеатозом печінки.
МАТЕРІАЛИ ТА МЕТОДИ
У дослідженні взяли участь 44 чоловіки віком 53-72 роки (медіана — 63 [58,0; 68,0] роки) з ІХС: стабільною стенокардією напруги 2-3 ФК. Згідно з дизайном у групу А (основну) увійшли 24 хворих віком 55-72 років (медіана — 64 [59,0; 69,0] роки) з ІХС у поєднанні з неалкогольним стеатозом печінки, у групу В (порівняння) — 18 хворих віком 53-70 років (медіана — 59,7 [56,0; 65,0] роки) з ІХС без неалкогольного стеатозу.
Діагноз ІХС встановлено згідно з уніфікованим клінічним протоколом первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Стабільна ішемічна хвороба серця» (Наказ МОЗ України № 152 від 02.03.2016 р.). Діагноз неалкогольного стеатозу печінки встановлено згідно з протоколами діагностики і лікування хвороб органів травлення (наказ МОЗ України № 271 від 13.06.2005 р.).
Критерії включення у дослідження:
– наявність документально підтвердженої ІХС (стабільна стенокардія напруги 2-3 ФК);
– наявність неалкогольного стеатозу печінки;
– інформована згода пацієнта.
Критерії виключення:
– інфаркт міокарда;
– гостре порушення мозкового кровообігу в анамнезі терміном до 6 міс;
– цукровий діабет;
– ожиріння 4 ступеня;
– наявність вірусного гепатиту;
– вживання будь-яких гіполіпідемічних препаратів за 4 тиж до початку дослідження.
Стабільна стенокардія напруги ІІ ФК встановлена у 15 (73%) пацієнтів групи А та у 8 (44%) осіб групи В, ІІІ ФК
– у 9 (58%) пацієнтів групи А та у 10 (55%) групи В; артеріальна гіпертензія 2-ї стадії – у 19 (78%) в групі А і у 9 (44%) в групі В; гострий інфаркт міокарда в анамнезі (більше 6 міс)
– у 3 (9%) в групі А та у 8 (44%) в групі В; гостре порушення мозкового кровообігу за ішемічним типом в анамнезі – у 6 (25%) пацієнтів в групі А і у 2 (11%) в групі В.
Лікування антигіпертензивними препаратами отримували пацієнти обох груп. Інгібітори ангіотензин перетворювального ферменту приймали 19 (79%) пацієнтів групи А і 15 (83%) осіб групи В, сартани — 5 (21%) в групі А і 3 (15%) в групі В, блока- тори кальцієвих каналів — 15 (62%) в групі А і 9 (50%) в групі В, бета-блокатори — 4 (17%) в групі А і 6 (33%) в групі В.
Усім хворим розраховували індекс маси тіла (ІМТ) за формулою Кетле, вимірювали зріст, визначали обсяг талії і стегон, масу тіла.
Рівень ТГ, загального холестерину (ЗХС), холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ) у сироватці
крові визначали методом ІФА з використанням реагентів фірми «Human» (Німеччина) на біохімічному аналізаторі «Chemistry Analyzer RT-1904C».
Рівень ХС ЛПНГ розраховували за формулою W.T. Friedewald [3]:
ХС ЛПНЩ=ЗХС–(ХС ЛПВЩ+ТГ/2,2).
Рівень лептину у сироватці венозної крові визначали методом ІФА за допомогою наборів реактивів ELISA фірми «DRG» (Німеччина). Референтним вважали рівень лептину в діапазоні 5,06-8,44 нг/мл.
Рівень С-реактивного білка (СРБ) методом аглютинації шляхом напівкількісного визначення у сироватці за допомогою наборів «HUMATEX» («Human», Німеччина) на напівавтоматичному аналізаторі «Chemistry Analyzer RT-1904C».
Дослідження функціонального стану ендотелію проводили шляхом розрахунку ендотелійзалежної вазодилатації (ЕЗВД) за результатом проби з реактивною гіперемією згідно з методикою, яку описав D. Celermajer [10]. При збільшенні діаметру артерії на 10% і вище функціональний стан ендотелію вважали збереженим. Враховуючи порушення толерантності до статинів в анамнезі, за даним лікаря або пацієнта, відмову від терапії статинами пацієнтам з ІХС у поєднанні з неалкогольним стеатозом з метою корекції атерогенной дісліпідеміі було призначено Омега-3 ПНЖК (ейкозапентаєнова кислота — ЕПК) і докозагексаєнова кислота (ДГК) у формі лікарського засобу Епадол НЕО виробництва АТ «Київський вітамінний завод» (Україна) в дозі 1000 мг 2 рази на добу. Результат оцінювали через 8 тиж спостереження (згідно з рекомендаціями Європейського товариства атеросклерозу).
Статистичне оброблення даних проводили з використанням пакетів програм «STATISTICA® for Windows 6.0» (StatSoft Inc.) із застосуванням методів непараметричної статистики. Кількісні ознаки представлені у формі меж інтер-квартильного відрізку [25%; 75%], якісні — у відсотках. Для порівняння показників у двох незалежних групах використовували U-критерій Манна-Уїтні, двох залежних груп – критерій Вілкоксона (Wilcoxon test), для оцінки взаємозв’язку між ознаками використовували кореляційний аналіз з розрахунком коефіцієнта рангової кореляції Спірмена (r). Статистично значущими відмінності вважали за р<0,05.
Усі пацієнти були проінформовані про проведення клінічного дослідження й дали письмову згоду на участь у дослідженні відповідно до етичних норм Гельсінської декларації.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
Під час аналізу клінічних характеристик у пацієнтів групи А виявлені достовірно вищі середні показники ІМТ, маси тіла, обсяг талії порівняно з показниками в групі В (р<0,05) (табл. 1). При цьому нормальна маса тіла (ІМТ від 18,5 до 24,9 кг/м2) виявлена у 4 (24%) пацієнтів групи В, надмірна маса тіла (ІМТ від 25 до 29,9 кг/м2) — у 6 (25%) в групі А та у 9 (52%) в групі В, ожиріння 1-го ступеня (ІМТ від 30 до 34,9 кг/м2) у 14 (60%) пацієнтів групи А та у 4 (24%) осіб групи В, ожиріння 2-го ступеня (ІМТ від 35 до 39,9 кг/м2) — у 4 (15%) пацієнтів групи А.
Під час аналізу біохімічних показників достовірних відмінностей основної групи та групи порівняння не виявлено. Так, середній рівень:
– загального білка становив 67,2 [68,2; 77,6] г/л у групі А та 73,7 [70,2; 78,4] г/л у групі В (р>0,05);
– загального білірубіну – 8,9 [3,1; 12,4] мкмоль/л у групі А та 13,4 [8,4; 13,3] мкмоль/л у групі В (р>0,05);
– АЛТ — 17,5 [14,7; 20,2] Од/л у групі А та 22,5 [14,7; 26,5] Од/л у групі В (р>0,05);
– АСТ — 20,9 [15,1; 22,6] Од/л у групі А та 24,1 [16,5; 21.3] Од/л у групі В (р>0,05);
– сечовини – 5,1 [4,6; 5,6] ммоль/л у групі А та 5,6 [5,0; 6.3] ммоль/л у групі В (р>0,05);
– креатиніну — 77,0 [75,0; 91,0] мкмоль/л у групі А та 90,2 [87,0; 94,0] мкмоль/л у групі В (р>0,05);
– глюкози — 5,5 [4,8; 5,6] ммоль/л у групі А та 5,4 [4,8; 5,7] ммоль/л у групі В (р>0,05);
– СРП — 4,1 [2,7; 5,7] мг/л у групі А та 3,1 [1,5; 3,77] мг/л у групі В відповідно (р>0,05).
.jpg)
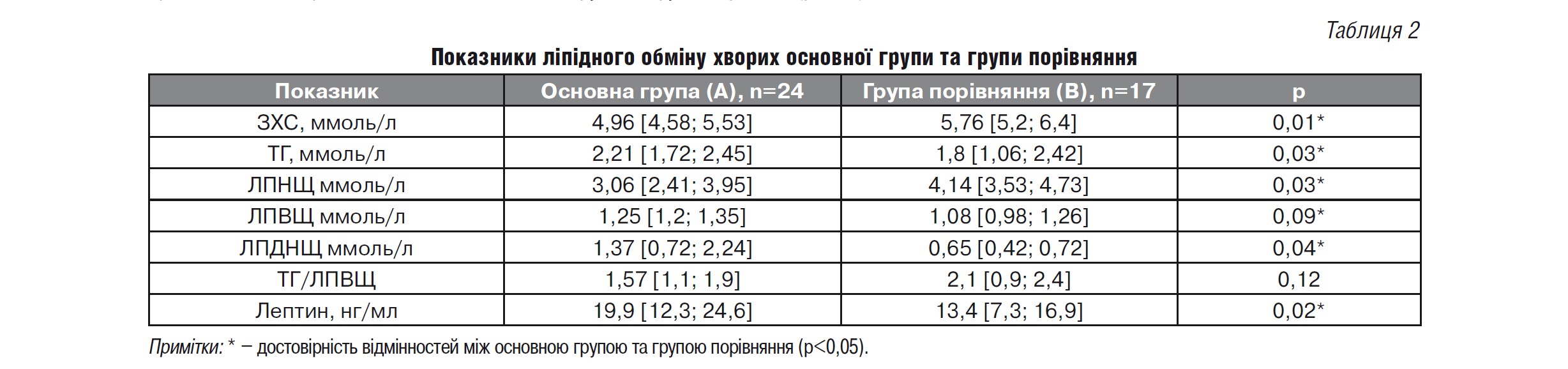
За показниками ліпідного спектра крові в основній групі виявлені достовірні відмінності за рівнями ЗХС, ТГ, ЛПНЩ, ЛПВЩ, ЛПДНЩ (табл. 2). У групі А виявлено достовірну кореляцію рівня ТГ з ЗХС (r=0,41; p<0,05), ЛПДНЩ (г=0,62; p<0,05), рівнем глюкози крові (r=0,73; p<0,05), ІМТ (r=0,68; p<0,05).
У групі пацієнтів з ІХС у поєднанні з неалкогольним стеатозом печінки виявлено підвищення рівня лептину у 20 (84%) осіб, у групі з ІХС без стеатозу – в 11 (67%) хворих. Рівень лептину корелював з рівнем СРП (r=0,54; p<0,05), АЛТ (r=0,76; p<0,05) та показником ЕЗВД (r=0,56; p<0,05) в основній групі на відміну від групи порівняння.
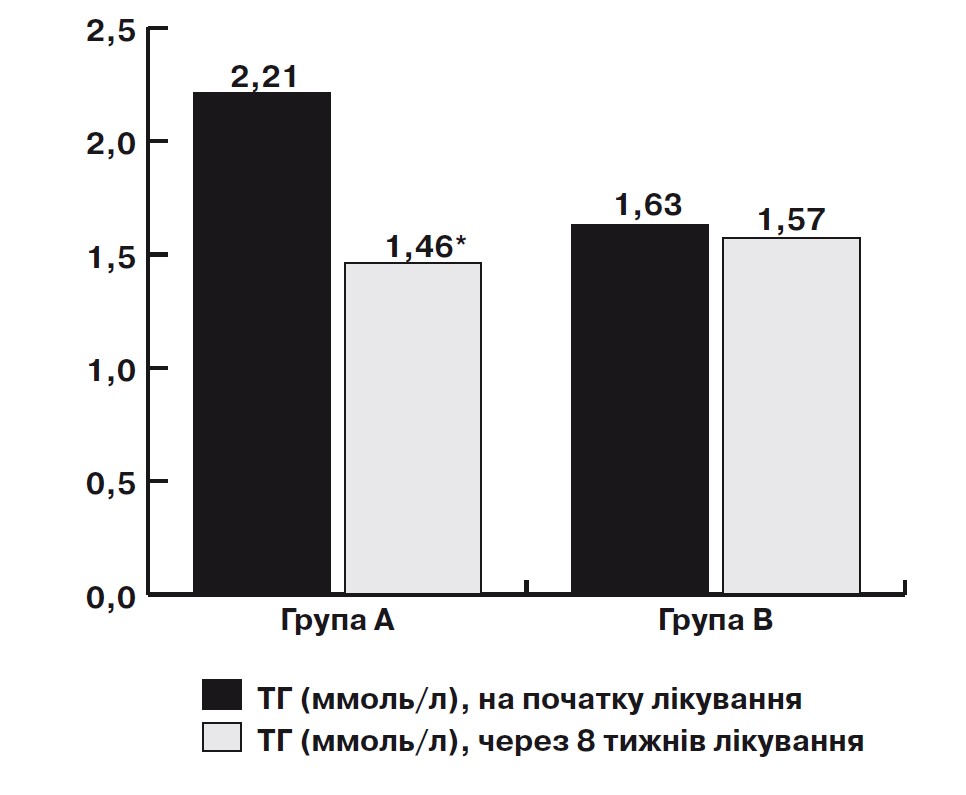
Примітка: * – достовірність за критерієм Вілкоксона, р<0,05.
Мал. 1. Динаміка змін рівня ТГ на тлі лікування омега-3
ПНЖК протягом 2 міс у дозі 1000 мг 2 рази на добу
у пацієнтів з ІХС у поєднанні з неалкогольним стеатозом
Під час аналізу функції ендотелію судин в основній групі зафіксовано зниження ЕЗВД у 20 (85%) хворих основної групи та у 9 (53%) осіб групи порівняння. Показник ЕЗВД (4,9 [4,5; 6,3]%) у хворих на ІХС у поєднанні з неалкогольним стеатозом печінки достовірно відрізнявся від хворих з ІХС без стеатозу печінки (9,1 [5,8; 11,1]%) (р=0,001). Виявлений прямий кореляційний зв’язок ЕЗВД з ЛПВЩ (r=0,62; p<0,05), рівнем СРП (r=0,64; p<0,05), обсягом талії (r=0,76; p<0,05) в основній групі.
Отже, важливо, щоб хворі на ІХС у поєднанні з неалкоголь- ним стеатозом печінки отримували безпечне та ефективне лікування з метою корекції дисліпідемії, як доведеного фактору прогресування серцево-судинних захворювань. Згідно із дизайном дослідження усім хворим основної групи було призначено Омега-3 ПНЖК кислоти (Епадол НЕО, АТ «Київський вітамінний завод», Україна) у дозі 1000 мг 2 рази на добу протягом 8 тиж. Хворі групи В приймали стандартну терапію ІХС.
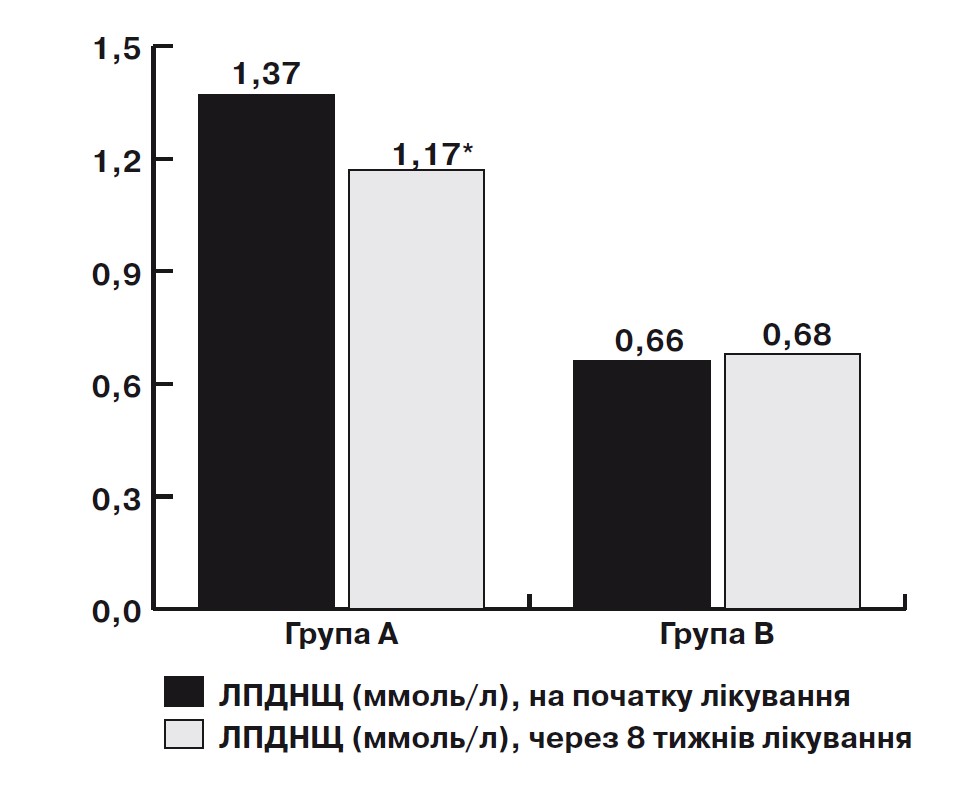
Примітка: * – достовірність за критерієм Вілкоксона, р<0,05.
Мал. 2. Динаміка змін рівня ЛПДНЩ на тлі лікування омега-3 ПНЖК протягом 2 міс у дозі 1000 мг 2 рази на добу у пацієнтів з ІХС у поєднанні з неалкогольним стеатозом.
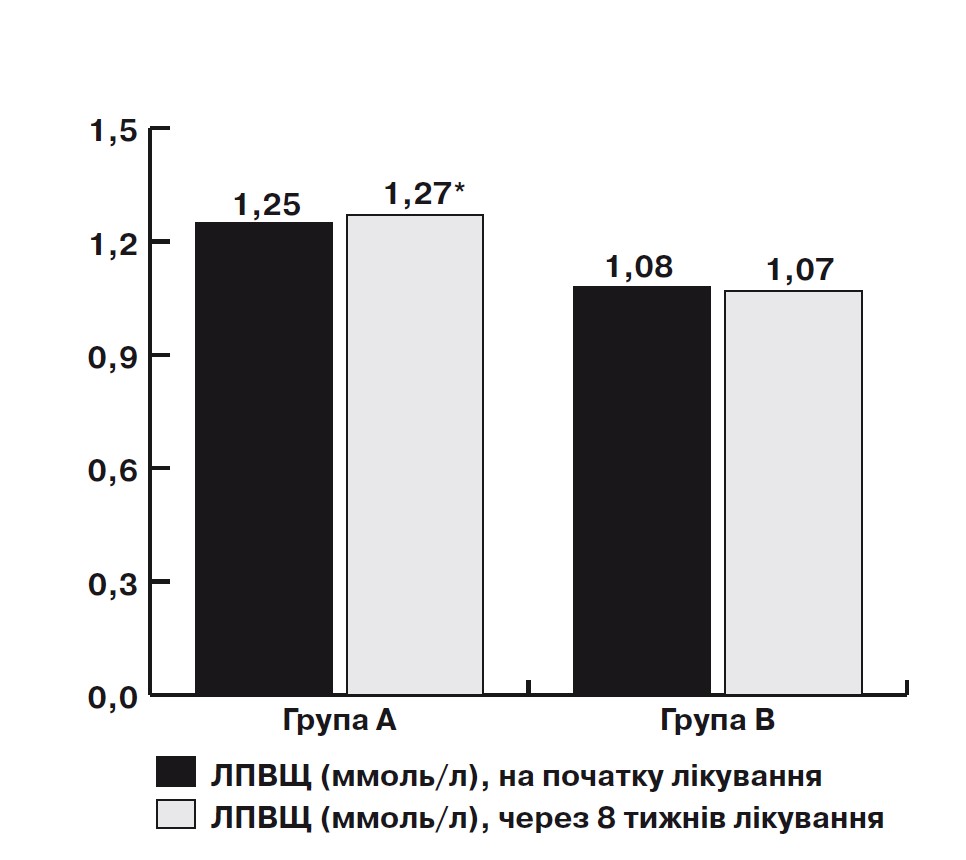
Примітка: * – достовірність за критерієм Вілкоксона, р<0,05.
Мал. 3. Динаміка підвищення рівня ЛПВЩ на тлі лікування омега-3 ПНЖК протягом 2 міс у дозі 1000 мг 2 рази на добу у пацієнтів з ІХС у поєднанні з неалкогольним стеатозом
Під час аналізу показників ліпідного спектра крові в основній групі на тлі вживання Омега-3 ПНЖК виявлено зниження рівня ТГ з 2,21 [1,72; 2,45] до 1,46 [1,25; 1,49] ммоль/л (на 42%; p=0,00008) (мал. 1), ЛПНЩ – з 3,06 [2,41; 3,95] до 2,89 [2,01; 3,75] ммоль/л (на 7%; p>0,05), ЛПДНЩ – з 1,37 [0,72; 2,24] до 1,17 [0,52; 2,01] ммоль/л (на 15%; p=0,02) (мал. 2), ЗХС – з 4,96 [4,58; 5,53] до 4,62 [4,58; 5,53] ммоль/л (на 8%; p>0,05). Виявлено достовірне підвищення рівня ЛПВЩ 1,25 [1,2; 1,35] до 1,27 [1,3; 1,38] (на 3%; p=0,02) (мал. 3). Достовірних відмінностей показників ТГ, ЛПНЩ, ЛПДНЩ, ЗХС у хворих групи В не виявлено.
На початку лікування високий рівень ТГ (2,2-5,6 ммоль/л) у сироватці крові зафіксовано у 12 (50%) хворих групи А, гранично високий рівень ТГ(1,7-2,2 ммоль/л) – у 12 (50%), а нормальний рівень ТГ (<1,7 ммоль/л) не спостерігався в жодного хворого. Через 8 тиж лікування омега-3 ПНЖК у 20 (83%) хворих рівень ТГ знизився до нормальних значень (<1,7 ммоль/л), що доводить ефективність гіполіпідемічної терапії омега-3 ПНЖК у хворих на ІХС у поєднанні з неалкогольним стеатозом.
Під час аналізу показники рівня лептину у сироватці крові на початку лікування омега-3 ПНЖК та через 8 тиж виявлено достовірне зниження його рівня з 19,9 [12,3;24,9] до 17,4 [9,3; 26,5] нг/мл (на 13%; p=0,002) за наявності кореляції рівня лептину з ТГ (г=0,56; p<0,05), ТГ/ЛПВЩ (г=0,67; p<0,05), рівнем глюкози (г=0,59; p<0,05) та ожирінням (г=0,56; p<0,05) (мал. 4).
Під час аналізу показників ЕЗВД у хворих на ІХС у поєднанні з неалкогольним стеатозом на тлі терапії омега-3 ПНЖК у 6 (24%) пацієнтів досягнуто нормалізації показників ЕЗВД. Зафіксовано достовірне підвищення показника ЕЗВД з 4,9 [4,5; 6,3]% до 6,4[4,7; 7,9]% (на 26%), що свідчить про наявність плейотропних ефектів омега-3 ПНЖК у даної групи хворих (мал. 5). Показник ЕЗВД у групі 2 на тлі стандартної терапії ІХС достовірно не змінився.
У хворих на ІХС у поєднанні з неалкогольним стеатозом на тлі терапії омега-3 ПНЖК виявлена позитивна динаміка у формі достовірного зниження рівня СРП з 4,1 [2,7; 5,7] до 3,2 [2,1; 4,7] (на 21%; p=0,03) та рівня глюкози сироватці крові з 5,5 [4,8; 5,6] до 3,6 [3,3; 4,8] ммоль/л (на 45%; p=0,01), що потребує додаткового вивчення плейотропних ефектів омега-3 ПНЖК у даної групи хворих.
Отже, виявлена позитивна динаміка у формі зниження рівня лептину, ТГ та ЛПДНЩ та підвищення рівня ЛПВЩ. Слід відзначити позитивну динаміку функції ендотелію і рівня СРП та тенденцію до зменшення показників рівня глюкози
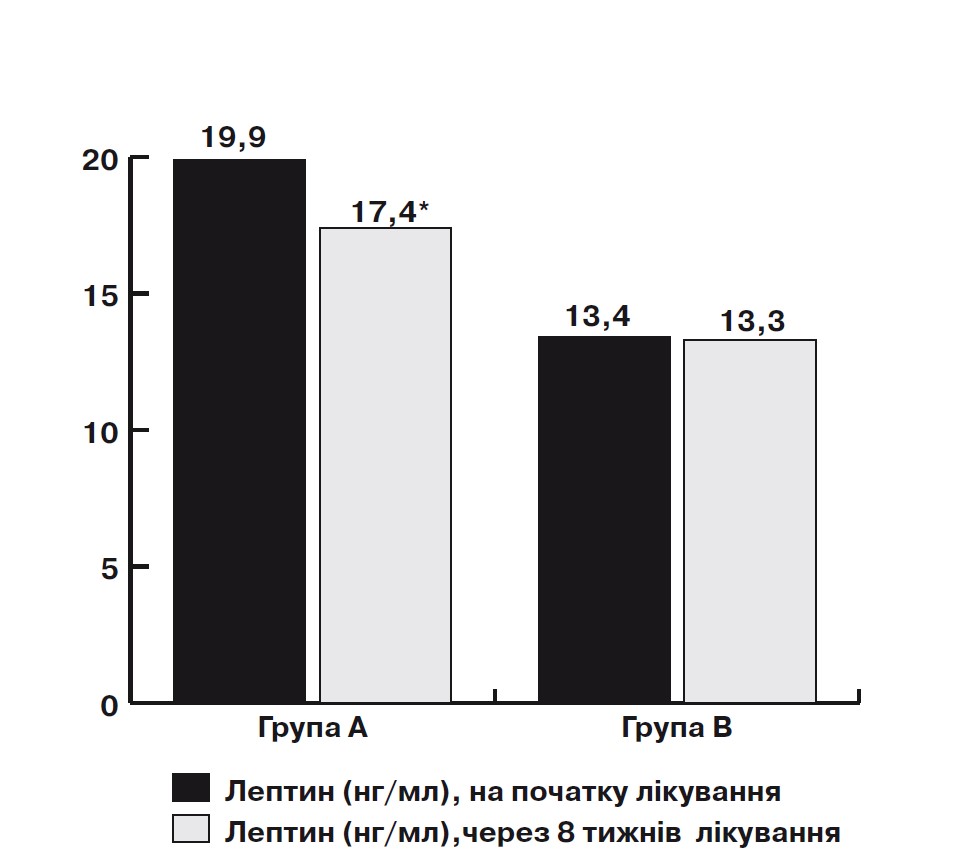
Примітка: * – достовірність за критерієм Вілкоксона, р<0,05.
Мал. 4. Динаміка підвищення рівня лептину на тлі лікування омега-3 ПНЖК протягом 2 міс у дозі 1000 мг 2 рази на добу у пацієнтів з ІХС у поєднанні з неалкогольним стеатозом
.jpg)
Примітка: * – достовірність за критерієм Вілкоксона, р<0,05.
Мал. 5. Динаміка змін ендотеліальної дисфункції на тлі лікування омега-3 ПНЖК протягом 2 міс у дозі 1000 мг 2 рази на добу у пацієнтів з ІХС у поєднанні з неалкогольним стеатозом
крові у хворих на ІХС у поєднанні неалкогольним стеатозом на тлі терапії омега-3 ПНЖК, що можливо вимагає подальшого дослідження для оцінювання ефективності більш тривалого використання омега-3 ПНЖК.
ВИСНОВКИ
1. У хворих на ішемічну хворобу серця (ІХС) та поєднаним неалкогольним стеатозом печінки на відміну від пацієнтів з ІХС без стеатозу виявлені достовірно більш високі показники рівня лептину, тригліцеридів та більш виражене порушення функції ендотелію за наявності кореляції рівня лептину з показником функції ендотелію, рівнем тригліцеридів та ожирінням.
2. Використання у лікуванні хворих на ІХС у поєднанні з неалкогольним стеатозом печінки препаратів омега-3 поліненасичених жирних кислот в якості вторинної профілактики забезпечує зниження рівня ТГ на 42% (p=0,00008), ЛПДНЩ на 15% (p=0,02), рівня лептину на 13% (p=0,002), СРП на 21% (p=0,03) та підвищення рівня ЛПВЩ на 3% (p=0,02) та покращення показника функції ендотелію на 26% (p<0,05).
СПИСОК ЛІТЕРАТУРИ
1. Гречаник М.М. Кардіогемодинаміка та показники пружно-еластичних властивостей каротидних артерій у хворих з ішемічною хворобою серця в поєднанні з неалкогольним стеатозом печінки / Гречаник М.М //Актуальні проблеми сучасної медицини: Вісник Української медичної стоматологічної академії. – 2017. – № 3 (59). – С. 101–105
2. Курята А.В. Атеросклероз магистральных артерий головы, уровень лептина и постпрандиальная гипертриглицеридемия у пациентов с ишемической болезнью сердца в сочетании с неалкогольной жировой болезнью печени в зависимости от индекса массы тела/ Курята А.В., Гречаник М.М. //Український терапевтичний журнал. – 2016. – № 4 (51). – С. 55–62.
3. Курята А.В. Взаимосвязь липидного спектра крови, уровня системного воспаления и массы тела у пациентов с ишемической болезнью сердца в сочетании с неалкогольной жировой болезнью печени и их динамика в условиях вторичной профилактики / Курята А.В., Гречаник М.М. // Медичні перспективи. – 2014. – Т. Х1Х (4). – С. 103–111.
4. Сиренко Ю.Н. Влияние омега-3 полиненасыщенных жирных кислот на функциональные свойства сосудов у больных артериальной гипертензией / Сиренко Ю.Н., Кушнир С.Н. // Український медичний часопис. – 2012. –
№ 4 (90) – С. 117–120.
5. Backes J. The clinical relevance of omega-3 fatty acids in the management of Hypertriglyceridemia / Backes J, Anzalone D, Hilleman D, et al // Lipids in Health and Disease. – 2016. – Vol. 15(1):118. DOI 10.1186/s12944- 016-0286-4
6. Ballestri S. Risk of cardiovascular, cardiac and arrhythmic complications in patients with non-alcoholic fatty liver disease / Ballestri S., Lonardo A., Bonapace S., Byrne C., Loria P., Targher G.// World J Gastroenterol. – 2014. – Vol. 20 (7). – Р. 1724–1745.
7. Bril F. Hepatic Steatosis and Insulin Resistance, But Not Steatohepatitis, Promote Atherogenic Dyslipidemia in NAFLD / Bril F, John J., Sninsky Arthur M., Baca H. et al. // The Journal of Clinical Endocrinology & Metabolism. – 2016. – Vol. 101, № 2. – P. 644–652.
DOI:10.1210/jc.2015-3111
8. Catapano A.L. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias / Catapano AL, Graham I, De Backer G, et al. // European Heart Journal. – Vol. 37, № 39. – P. 2999–3058.
9. Cicero A.F. Lipid-lowering and antiinflammatory effects of omega 3 ethyl esters and krill oil: a randomized, crossover, clinical trial / Cicero A.F., Rosticci M. , Morbini M. et al // Arch Med Sci. – 2016. – Vol. 12 (3). – Р. 507–12. doi: 10.5114/ aoms.2016.59923
10. Celermajer D. Endothelial dysfunction: does it matter? It is relevant? // Journal American Collage Cardiology. – 1997. – Vol. 30. – P. 325–333.
11. Kusunoki C. Omega-3 polyunsaturated fatty acid has an anti-oxidant effect via the Nrf-2/HO-1 pathway in 3T3-L1 adipocytes. / Kusunoki C, Yang L, Yoshizaki T, et al. // Biochem Biophys Res Commun. – 2013. – Vol. 430. – Р. 225–30.
12. Piepoli MF, Hoes AW, Agewall S, et al. European Guidelines on cardiovascular disease prevention in clinical practice // European Heart Journal. – 2016. – Vol. 37, № 29. – P. 2315–2381.
13. Sattar N. Leptin and coronary heart disease: prospective study and systematic review / Sattar N, Wannamethee G, Sarwar N, et al.// J Am Coll Cardiol. – 2009. – Vol. 3753 (2). – Р. 167–75.
15. Weintraub H. Update on marine omega-3 fatty acids: management of dyslipidemia and current omega-3 treatment options / Weintraub H. // Atherosclerosis. – 2013. – Vol. 230 (2). – Р. 381–9. doi: 10.1016/j. atherosclerosis.2013.07.041.
15. Yang,H. Leptin concentration and risk of coronary heart disease and stroke: systematic review and meta-analysis / Yang H Guo, W Jie Li, Shengli Cao et al // PLoS One. – 2017. – Vol. 12 (3): e0166360. doi: 10.1371/journal.pone. 0166360
15. Zeng R. Association of leptin levels with pathogenetic risk of coronary heart disease and stroke: a meta-analysis / Zeng R., Xu Chun-Hua, Yuan-Ning Xu, Ya-li Wang1, Mian Wang // Arq Bras Endocrinol Metabol. – 2014. – Vol. 58 (8).
– P. 817–23.
Стаття надана мовою оригіналу






