
 Article
Article
 04.03.2025
04.03.2025
Вивчення ефективності структурно-модифікуючих препаратів у хворих на гонартроз
Шуба Н.М., Воронова Т.Д., Крилова А.С., Данішевська Г.В. Національна медична академія післядипломної освіти ім. П.Л.Шупика
Резюме. Призначення діацереїну при лікуванні остеоартрозу може сповільнити його подальший розвиток, зменшити біль, поліпшити якість життя. Оцінено динаміку клінічних проявів суглобового синдрома при прийомі діацереїну за ВАШ, альгофункціональними індексами Лекена, WOMAC. Досліджено вплив діацереїну на рівні цитокінів (IL-1β, TNF-a, IGF-1, TGF-b, NO), показники обміну речовин ( ліпідний, вуглеводний, печінкові маркери), рівень сечової кислоти.
Ключові слова: остеоартроз, протизапальний ефект, структурно-модифікуючий ефект, діацереїн
Остеоатроз — гетерогенна група дегенеративних захворювань суглобів різної етіології з подібними біологічними, морфологічними та клінічними проявами і наслідками. Остеоартроз (OA) є захворюванням “цілого суглоба”, який включає серію молекулярних змін в хрящі і субхонд-ральній кістці, які ускладнені запальним процесом в синовіальній оболонці, ураженням капсули суглоба, зв’язок та м’язів.( Abramson SB, Attur M., 2009)
Запалення, яке раніше вважали вторинним, зараз розглядається в якості первинної події при остеоартриті.( Saxne T, Lindell M, 2003, Benito MJ, Veale DJ, 2005)
Серед різних факторів, які відповідальні за патогенетичні зміни та запалення в суглобі, виділяють цитокіни. Цитокіни, які беруть участь у метаболізмі хряща поділяють на три категорії:
- Катаболічні цитокіни (IL-1β, TNF-а, IL-17, та IL -18),
- Регулюючі цитокіни (IL-4, IL-10, IL-11,IL-13,антагоніст рецептора IL-1, інтерферон-γ)
- Анаболічні цитокіни (IGF-1, TGF-β1, TGF-β2, TGF-β3, фактори росту фібробластів [FGF-2, FGF-4, FGF-8], кісткові морфогенетичні білки [ВМР-2, ВМР-4, ВМР-6, BMP-7, BMP-9 і ВМР-13]) ( Goldring MB, Otero M, 2008)
IL‑1 та TNFα є найбільш добре вивченими прозапальними цитокінами при ОА.( Stannus O, Jones G, Cicuttini F, et al.,2010). Катаболічна дія IL‑1 та TNFα здійснюється через інгібування синтеза протеогліканів та колагену ІІ типу. (Keny MS, Bhounsule SA, Rataboli PV., 2014) На ранніх етапах остеоартрита TNFα має більш високі значення та корелює із стадією ОА, що вказує на більш інтенсивну запальну реакцію( Csifo Enikő, Katona Tímea 2014).
IL‑1 – підвищуює експресію гена металопротеаз (ММП)(Kobayashi M, Squires GR, et al., 2005), індукує синтез простагландину Е2 (ПГЕ2) і виробництво оксиду азоту (NO) через індуцібельну NO синтетазу (iNOS, або NOS2), стимулює продукцію інших цитокінів, таких як IL-6, фактор інгібування лейкозу, IL -17, IL -18, хемокіни. (Goldring MB, Goldring SR., 2007) та власну продукцію, що забезпечує постійне пошкодження хряща.
Серед анаболічних цитокінів найбільшу цікавість викликають IGF-1 та
TGF-β. Інсуліноподібні фактори росту в великій кількості знаходяться в сироватці крові, мають ряд спільних властивостей з інсуліном (є його структурним і функціональним аналогом). IGF-2 – більш характерний для ембріональної стадії розвитку, тоді як IGF-1- домінуючий представник групи у дорослої людини. IGF-1 сприяє проліферації і диференціюванню хондроцитів в пошкодженому матриксі та гальмує апоптоз.(Hutchison MR, Bassett MH, White PC.,2007.), що свідчить про його участь в процесах репарації.
TGF-β є членом великого суперсімейства трансформуючих факторів росту, має спільні функціональні та сигнальні властивості з факторами росту кісткових морфогенетичних білків. TGF-β регулює клітинну проліферацію, диференціювання, та функціонування екстрацелюлярного матриксу.( Roberts AB, Sporn MB.,1993) TGF-β стимулює синтез колагену і протеогліканів і знижує діяльність металопротеаз, індукованих IL-1 (Finnson KW, Parker WL.,2010). Крім того, TGF-β підвищує експресію TIMP (тканинного інгібітора металопротеаз), таким чином також інгібуючи їх активність.
Тому, в обґрунтуванні вибору структурно-модифікуючої терапії має важливе значення нейтралізація прозапальних цитокінів та вільних радикалів на фоні стимуляції факторів росту. Серед структурно-модифікуючих препаратів виділяють хондроїтина сульфат-4 і-6, глюкозаміни (глюкозаміна сульфат) і діацереїн. Недавні дослідження препаратів з цієї групи, зокрема діацереїну, показали його вплив на окремі катаболічні та анаболічні медіатори (Moldovan F.et al., 2000,Sanchez C. et al., 2003, Martin G. et al., 2003).
Враховуючи вищевказане, на базі терапевтичного відділення Клінічної міської лікарні №7 м.Києва була виконана робота з вивчення ефективності застосуваня діацереїна у пацієнтів з гонартрозом.
Спочатку оцінювали функціональний стан суглобового синдрому у пацієнтів. У дослідження було включено 152 пацієнта (123 жінки та 29 чоловіків) з гонартрозом (I-III рентгенологічна стадія по Келгрен – Лоуренсу) у віці від 19 до 75 років. Хворі приймали діацереїн в дозі 50 мг 2 рази на добу протягом 3 міс. Функціональний стан хворих оцінювали за анкетою Western Ontario and McMaster University osteoarthritis index (WOMAC). У процесі дослідження 3 пацієнта вибуло у зв’язку з розвитком діареї.
При аналізі показників больового синдрому та функціонального стану хворих за анкетою WOMAC (біль у спокої і при навантаженні, скутість,обмеження в повсякденній діяльності) спостерігали достовірне зниження (р <0,05) всіх показників вже через 3 міс від початку дослідження(рис. 1)
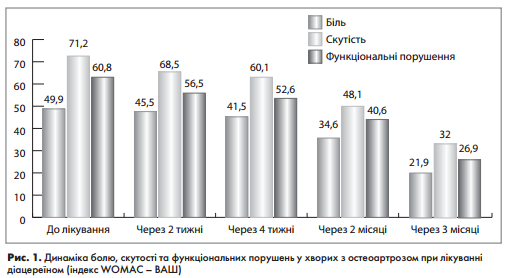
Крім того, зберігався терапевтичний ефект і після відміни препарату (рис. 2).
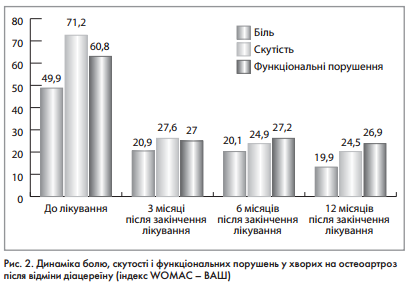
Враховуючи отримані результати та позитивний ефект лікування, ми провели ще одне дослідження ефективності діацереїна у пацієнтів з гонартрозом протягом уже 6 місяців.
Матеріали та методи дослідження
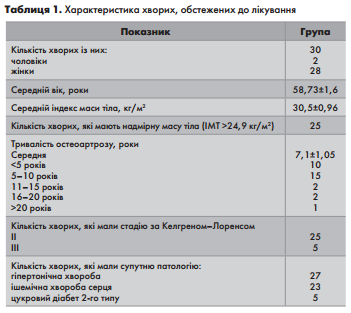
В дослідження було включено 30 пацієнтів з гонартрозом ( 28 жінок та 2 чоловіків) в віці від 35 до 75 років. Тривалість захворювання в середньому склала 7,1±1,05 років ( менше 5 років –10 чоловік, 5-10 років – 15 чоловік, 11-15 років – 2 людини, 16-20 років –2 людини, більше 20 років – 1 людина)
Загальна характеристика обстежених хворих висвітлена у таблиці 1.
Критерії включення:
- Діагноз остеоартроз колінних суглобів, що відповідає критеріям EULAR.
- Чоловіки та жінки , будь-якої раси, в віці 35-75 років.
- До початку дослідження пацієнти страждали від больових відчуттів не менше 15 з 30 днів, а загальні симптоми захворювання відмічались протягом не менше півроку.
- Рентгенологічне підтвердження діагнозу остеоартроз ( стадія за Келгреном-Лоренсом І-ІІІ)
- Оцінка за шкалою ВАШ 40 мм і більше при ходьбі
- Індекс Лекена від 4 балів
- Супутні захворювання артеріальна гіпертензія І-ІІІ ступеня (систолічний АТ >140 мм.рт.ст., діастолічний АТ > 90 мм.рт.ст.), ІХС: стенокардія напруги І-ІІІ ФК, цукровий діабет ІІ типу
- Доза гіпотензивних та цукрознижуючих препаратів повинна бути незмінною протягом всього дослідження, тривалість прийому на момент включення в дослідження повинна складати не менше 3 місяців. Пацієнти, які не приймають на момент первинного огляду препарати вказаних груп, також можуть бути включені в дослідження.
Критерії виключення:
- Гіперчутливість до досліджуваного препарата.
- Одночасне застосування інших хондропротекторів
- Супутні захворювання: загострення виразкової хвороби шлунка та дванадцятипалої кишки, захворювання органів кровотворення, тяжкі інфекційні захворювання, печінкова, ниркова недостатність, клінічно значимі стадії серцево-легеневої недостатності.
- Наявність злоякісних новоутворень.
- Недієздатність або обмежена дієздатність.
- Участь в будь-якому іншому клінічному дослідженні.
Всім хворим до початку лікування і через 3 і 6 місяців терапії проводилися традиційні клінічні методи дослідження, що включали збір сімейного та індивідуального анамнеза. Індекс маси тіла (ІМТ) розраховувався за формулою: ІМТ = маса тіла (кг) / зріст² (м²)
Вираженість суглобового синдрому оцінювалася за наступними параметрами: біль при русі ( 0 -10см за ВАШ), індекс WOMAC, індекс Лекена. Всім пацієнтам на початку спостереження проводили рентгенологічне дослідження колінних суглобів в прямій ( передньозадній ) і боковій проекції. Рентгенологічну стадію остеоартроза визначали за класифікацією J.H. Kellgren, J.S. Lawrence (1957) ( Kellgren J.H., Lawrence J.S.,1957)
Всім хворим, що знаходились під нашим наглядом, проводились загальноклінічні обстеження: загальний аналіз крові та сечі, глюкоза крові(ммоль/л), біохімічний аналіз крові з визначенням білірубіну (мкмоль/л), АлАТ, АсАТ, креатиніну (мкмоль/л), сечовини (ммоль/л).
Імунологічні дослідження включали кількісне визначення в сироватці крові рівня IL-1β (Bender MedSystems GmbH, Австрія), TNF-a (Orgenium,Фінляндія), IGF-1(DRG, Німеччина),TGF-b (DRG, Німеччина), NO імуноферментним методом. Облік реакції проводили на імуноферментному аналізаторі Lab-line – 100 (WestMedica, Австрія).
Визначення концентрації холестерину в крові проводили за допомогою набору реактивів «HUMAN», Німеччина, сечової кислоти – «Філіст-Діагностика», Україна.
Для статистичної обробки даних застосовували програмно-математичний комплекс для персонального комп’ютера „Microsoft Exel 2007” (Microsoft) та комп’ютерні програми для статистичного аналізу та обробки даних „Биостатистика”, „STATISTICA® 6.0” (StatSoftInc., США), „ SPSS Statistics 20” (IBM, США).
Для лікування був використаний діацереїн ( «ФЛЕКЦЕРИН», ПАТ «Київський вітамінний завод» номер реєстраційного посвідчення UA/12618/01/01) в дозі 50 мг двічі на добу протягом 6 місяців у всіх 30 пацієнтів.
Отримані результати
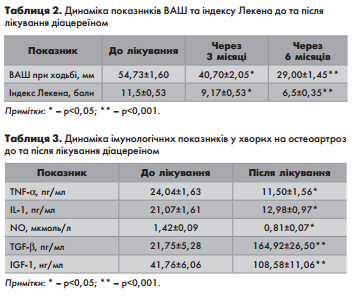
Оцінюючи біль за ВАШ, відмічено статистично достовірне зменшення її інтенсивності уже через 3 місяці лікування, та майже вдвічі через півроку застосування діацереїну в порівнянні з початковими величинами (табл.2)
Результати оцінювання тяжкості гонартроза за індексом Лекена свідчать про позитивну його динаміку (табл.3). Так, відмічено статистично достовірне зниження альгофункціонального індексу Лекена через 3 та 6 місяців лікування.
Було розраховано індекс WOMAC ( Western Ontario and McMaster Universities Osteoarthritis Index), який також достовірно зменшувався. Рівень болю за WOMAC напочатку склав 232,77±13,29мм, після 6 місяців – 119,47±8,55мм(р<0,001). Показник обмеження рухів в суглобі вранці та протягом дня за WOMAC на початку виявився 111,63±6,80 мм та після 6 місяців – 55,7±3,5мм(р<0,001). Показник обмеження повсякденної активності за WOMAC на початку склав 767,57±29,87мм та після 6 місяців – 548,83±
34,29мм(р<0,001).
Наприкінці дослідження, через 6 місяців лікування, ми отримали статистично достовірне зниження прозапальних цитокінів (TNF-a, IL-1), вільних радикалів (NO) (табл.4, рис.4). А також статистично достовірне підвищення анаболічних цитокінів (TGF-b, IGF-1). Ці дані свідчать про властивість діацереїна знижувати інтенсивність запального процесу та підвищувати процеси регенерації у пацієнтів з гонартрозом.
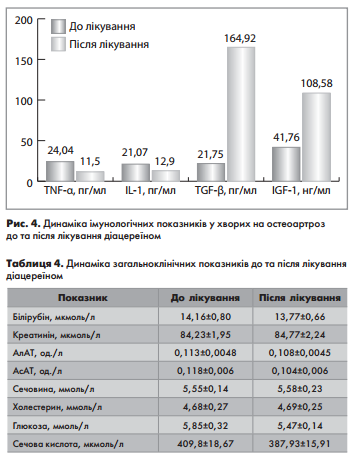
Не було відмічено динаміки лабораторних показників глюкози крові, ліпідного обміну, білірубіну, печінкових маркерів, креатиніну та сечовини, які у більшості хворих до включення у дослідження були в межах нормальних значень (табл.4)
Проте, була виявлена тенденція зниження рівня сечової кислоти, яка до лікування була 409,8±18,67 мкмоль/л, після лікування діацереїном 387,93±15,91 мкмоль/л. Отримані дані свідчать про можливість застосування препарату у пацієнтів із супутньою патологією, та позитивний ефект діацереїну у пацієнтів з гіперурикемією.
Внаслідок проведеного аналізу отриманих даних, які викладені вище, можна зробити наступні висновки:
- Виявлено позитивний вплив діацереїну на динаміку показників суглобового синдрому, а саме статистично достовірне зниження вираженості болю по ВАШ , альгофункціональних індексів WOMAC і Лекена.
- При застосуванні діацереїну отримано статистично достовірне зниження прозапальних цитокінів (TNF-a, IL-1), вільних радикалів (NO), а також статистично достовірне підвищення анаболічних цитокінів (TGF-b, IGF-1). Ці дані свідчать про властивість діацереїна знижувати інтенсивність запального процесу та підвищувати процеси регенерації у пацієнтів з гонартрозом.
- Не було відмічено динаміки лабораторних показників глюкози крові, ліпідного обміну, білірубіну, печінкових маркерів, креатиніну та сечовини, що свідчить про можливість безпечного застосування препарату у пацієнтів із супутньою патологією.
- При застосуванні діацереїну не вімічалось підвищення рівня сечової кислоти, що важливо при лікуванні хворих з гіперурикемією.
Література
- Abramson SB, Attur M. (2009)Developments in the scientific understanding of osteoarthritis. Arthritis Res Ther. 11(3):227.
- Benito MJ, Veale DJ, FitzGerald O, van den Berg WB, Bresnihan B. (2005) Synovial tissue inflammation in early and late osteoarthritis. Ann Rheum Dis., 64(9):1263-1267.
- Csifo Enikő, Katona Tímea, Arseni Juliánna, Nagy E, Gergely I, Nagy Ö (2014)Correlation of Serum and Synovial Osteocalcin, Osteoprotegerin and Tumor Necrosis Factor-Alpha with the DiseaseSeverity Score in Knee Osteoarthritis. Acta Medica Marisiensis, 60(3):102-105
- Finnson KW, Parker WL, Chi Y, Hoemann CD, Goldring MB, Antoniou J, Philip A. (2010) Endoglin differentially regulates TGF-β-induced Smad2/3 and Smad1/5 signalling and its expression correlates with extracellular matrix production and cellular differentiation state in human chondrocytes.Osteoarthritis Cartilage. Nov;18(11):1518-27.
- Goldring MB, Goldring SR. (2007)Osteoarthritis. J Cell Physiol., 213(3):626-634.
- Goldring MB, Otero M, Tsuchimochi K, Ijiri K, Li Y (2008) Defining the roles of inflammatory and anabolic cytokines in cartilage metabolism. Ann Rheum Dis 67 Suppl 3: iii75-82.
- Hutchison MR, Bassett MH, White PC. (2007) Insulin like growth factor I and fibroblast growth factor, but not growth hormone, affect growth plate chondrocyte proliferation. Endocrinology.,148(7):3122 – 3130.
- Keny MS, Bhounsule SA, Rataboli PV. (2014) Knee osteoarthritis a pathological basis for use of newer drug therapies. Int J Basic Clin Pharmacol., 3(3): 424-430
- Kobayashi M, Squires GR, Mousa A, Tanzer M, Zukor DJ, Antoniou J, et al. (2005) Role of interleukin 1 and tumor necrosis factor alpha in matrix degradation of human osteoarthritic cartilage. Arthritis Rheum., 52(1):128-135.
- Martin G., Bogdanowicz P., Domagala F. et.al. (2003) Rhein inhibits interleukin-l beta-induced activation of MEK/ERK pathway and DNA binding of NF-kappa B and AP-I in chondrocytes cultured in hypoxia: a potential mechanism for its disease-modifying effect in osteoarthritis. Inflammation, 27(4): 233–246.
- Moldovan F., Pelletier J.P., Jolicoeur F.C. et.al. (2000) Diacerhein and rhein reduce the ICE-induced IL-ip and IL-18 activation in human osteoarthritic cartilage. Osteo Cart, 8: 186–196.
- Roberts AB, Sporn MB. (1993)Physiological actions and clinical applications of transforming growth factor beta (TGF beta). Growth Factors.;8(1):1-9.
- Sanchez C., Mathy-Hartert M., Deberg M.A. et al. (2003) Effects of rhein on human articular chondrocytes in alginate beads. Biochem Pharmacol., 65(3): 377–388.
- Saxne T, Lindell M, Maynsson B, Petersson IF, Heinegayrd D. (2003) Inflammation is a feature of the disease process in early knee joint osteoarthritis. Rheumatology (Oxford)., 42(7):903- 904.
- Stannus O, Jones G, Cicuttini F, et al. (2010) Circulating levels of IL-6 and TNF-a are associated with knee radiographic osteoarthritis and knee cartilage loss in older adults. Osteoarthritis and Cartilage.,18 :1441-1447
Стаття надана мовою оригіналу





