
 Article
Article
 04.03.2025
04.03.2025
Відкрите рандомізоване порівняльне паралельне клінічне дослідження антигіпертензивної ефективності генерічного та брендового комбінованих препаратів ірбесартану та гідрохлортіазиду при гіпертонічній хворобі II-ІІІ ступеню
Ю.М.Сіренко, Г.Д.Радченко, С.А.Поліщук, П.І.Сідоренко ДУ «ННЦ Інститут кардіології ім. акад. М.Д.Стражеска» НАМН України, м. Київ
ВСТУП
На сьогоднішній день артеріальна гіпертензія (АГ) є найбільш поширеним хронічним захворюванням в світі та на Україні [1]. Підвищений артеріальний тиск (АТ) спостерігається у кожної третьої дорослої людини. На ряду з високою поширеністю, хронічно підвищений АТ є фактором ризику виникнення важких ускладнень (інфаркт міокарда, інсульт, серцева та ниркова недостатність, ретинопатія та інш.) та смерті. Ризик розвитку цих ускладнень збільшується при підвищенні як систолічного АТ (САТ), так і діастолічного АТ (ДАТ) у хворих усіх вікових категорій і обох статей [5, 6, 19]. Приблизні підрахунки показують, що прямі економічні збитки внаслідок тимчасової непрацездатності, інвалідності та передчасної смерті в Україні щороку перевищують 2 млрд. гривен [1]. Крім того, певні економічні втрати для держави становлять витрати, пов’язані з лікуванням і реабілітацією зазначеної категорії хворих.
Особливістю АГ є і те, що дане захворювання відносно легко лікується постійним прийом антигіпертензивних препаратів. Доведено, що зниження АТ усього на 10/5 мм рт.ст. зменшує ризик виникнення будь-яких серцево-судинних ускладнень на 10%, а на 20/10 мм рт.ст. – до 20% [5, 21, 23]. Так само, за даними клінічних досліджень, показано, що раціональне застосування антигіпертензивних препаратів дозволяє досягнути “цільового АТ” (менше 140 та 90 мм рт.ст.) майже у 80%. Про те, реально на практиці тільки 15-20% осіб з підвищеним АТ ефективно лікується [2, 8, 9, 11, 12, 16].
На теперішній час для медикаментозного лікування пацієнтів з АГ широко застосовуються препарати – блокатори ренін-ангіотензинової системи (РАС). Вони, перш за все, показані хворим з АГ та ознаками серцевої недостатності, ураженням нирок, метаболічним синдромом, цукровим діабетом, фібриляцією передсердь, гіпертрофією лівого шлуночка [4, 5, 6, 13, 23]. До цієї групи відносяться два класи ліків першої лінії терапії АГ – інгібітори ангіотензин-перетворюючого ферменту (АПФ) та блокатори рецепторів ангіотензину ІІ (БРА). Найбільш популярними є їх комбінації з діуретиками, частіше з гідрохлортіазидом. У великих клінічних дослідженнях для лікування АГ частіше застосовувалася саме така комбінація.
Окрім, спрощення режиму прийому антигіпертензивних препаратів, для збільшення прихильності хворого до терапії має значення ефективне зниження АТ при найменшій кількості побічних реакцій. У такому випадку існує більша вірогідність, що пацієнт залишиться на призначеній йому терапії. Щодо ефективності, то на теперішній момент не має переваги якоїсь групи антигіпертензивних препаратів у ступені і частоті зниження АТ. Лідерами же щодо найменшої кількості побічних реакцій серед антигіпертензивних препаратів є БРА. За даними багатьох досліджень частота виникнення побічних реакцій на препаратах цієї групи менша, ніж при прийомі плацебо [13, 21]. А, за даними K.Chen з співавторами, призначення БРА асоціювалося із вірогідністю того, що пацієнти будуть продовжувати терапію в 81,9% випадків, тоді як діуретики – у 70,9%, інгібітори АПФ – у 74%, АК – у 79%, БАБ – у 76,7% [5]. Тобто, дана група ліків може забезпечувати більшу прихильність до лікування при тій же ефективності.
За механізмом дії БРА II принципово відрізняються від інгібіторів АПФ, оскільки рівень ангіотензину II при цьому в крові не змінюється, а іноді навіть підвищується. Крім того, при застосуванні інгібіторів АПФ, незважаючи на блокування утворення ангіотензину II, з плином часу рівень цього пептиду може повернутися до норми через альтернативні шляхи його утворення за допомогою інших ферментів, що каталізують перетворення ангіотензину I в ангіотензин II [24]. Крім того, як свідчить ряд експериментальних робіт, стимуляція ангіотензином II незаблокованих рецепторів АТ 2 може зіграти додаткову позитивну роль, оскільки відбувається збільшення NO як через брадикінін-залежний, так і брадикінін-незалежний механізми.
До представників БРА відноситься ірбесартан, ефективність та безпечність якого доведено у хворих з АГ, на цукровий діабет з нефропатією, при метаболічному синдромі [7, 10, 14, 15, 17, 18, 20, 22].
Метою даного дослідження було оцінити терапевтичну еквівалентність за показниками ефективності генеричного комбінованого препарату ірбесартан/гідрохлортіазид (Ірбетан-Н, виробництва ПАО «Київський вітамінний завод») лікарському препарату «Ко-апровель®» 300/12,5 мг, виробництва компанії «Sanofi Winthrop Industri», Франція в лікуванні гіпертонічної хвороби ІІ-ІІІ ступеню.
Задачами дослідження були: вивчити терапевтичну ефективність препаратів, що досліджуються, в лікуванні гіпертонічної хвороби; вивчити переносимість та можливі побічні реакції препаратів, що досліджувалися; порівняти ефективність лікування в основній та контрольній групах та оцінити терапевтичну еквівалентність препаратів, що досліджувалися.
Матеріали та методи
У дослідження було включено 90 пацієнтів з АГ 2-3 ступеню за класифікацією ВООЗ, які проходили стаціонарне або амбулаторне лікування у відділенні симптоматичних артеріальних гіпертензій Національного наукового центру «Інститут кардіології імені академіка М.Д.Стражеска» АМН України. Критеріями включення у дослідження були: вік 25-75 років, ессенціальна АГ ІІ стадії, рівень систолічного (САТ) та/або діастолічного (ДАТ) АТ > 160/100 мм рт. ст. в кінці періоду відміни усіх антигіпертензивних препаратів, відсутність критеріїв виключення, підписання пацієнтом інформованої згоди на участь у дослідженні, можливості пацієнта до адекватного співробітництва. Не включалися пацієнти з рівнем АТ > 220/140 мм рт.ст.; вторинною та злоякісною АГ; з наявністю в анамнезі таких ускладнень, як інфаркт міокарду, інвазивні та неінвазивні втручання на серці, порушення мозкового кровообігу в строках менше ніж за три місяці до включення у дослідження; порушенням серцевого ритму (постійна форма фібриляції передсердь, часта шлуночкова або суправентрикулярна екстрасистолія, артріовентрикулярна блокада ІІ та ІІІ ступеню, синдром слабкості синусового вузла, брадикардія); серцева недостатність ІІІ-IV функціонального класу (NYHA); стенокардія напруги ІІІ-IV функціонального класу; тромбоемболією легеневої артерії; недостатністю лактази, галактоземією або синдромом порушення всмоктування глюкози/галактози в анамнезі; з анафілактичними реакціями в анамнезі; ретинопатією ІІІ та IV стадії, вираженою хронічною нирковою недостатністю (креатини > 220 мкмоль/л, анурія); стеноз ниркових артерій, стенози мітрального та аортального клапанів; з кардіоміопатіями; з декомпенсованим цукровим діабетом; з декомпенсованим ураженням печінки; порушенням кровотворення; з подагрою; з психічними розладами; з онкологічними захворюваннями; вагітні жінки або з лактацією; з підвищеною чутливістю до компонентів терапії в анамнезі; з анеміями; з інфекційними захворюваннями; з відсутністю контактної інформації; з необхідністю призначати інші антигіпертензивні або антиангінальні препарати; з епізодами гіпотензії; з клінічно значущими відхиленнями лабораторних показників, в тому числі із рівнем калію, натрію, сечової кислоти та кальцію сироватки крові, що виходили за межі норми; пацієнти, що приймають участь в інших клінічних дослідженнях.
Умовами припинення дослідження були: індивідуальна непереносимість препарату, поява тяжких або неочікуваних побічних реакцій, які потребують на думку дослідника або пацієнта відміни, значне погіршення загального стану в період дослідження, порушення пацієнтом протоколу дослідження, зміни лабораторних показників, які свідчать про потенційну загрозу для пацієнта, відзив пацієнтом інформованої згоди. При достроковому припиненні участі у дослідженні пацієнт замінювався іншим. Згідно критеріям включення та виключення. Новому пацієнту присвоювали наступний порядковий номер та він включався у ту групу, з якої вибув пацієнт.
Дане клінічне дослідження проводилося згідно Закону України «Про клінічні засоби» та за етичними принципами, що викладені в Хельсинській декларації, а також згідно «Інструкції з проведення клінічних досліджень та експертизі матеріалів при клінічних дослідженнях», що затверджена наказом МОЗ України від 01.11.2000 року. Дослідження було розпочато після затвердження протоколу дослідження Комісією з питань етики при ДУ «ННЦ «Інститут кардіології імені академіка М.Д.Стражеска» НАМН України 08.04.2012.
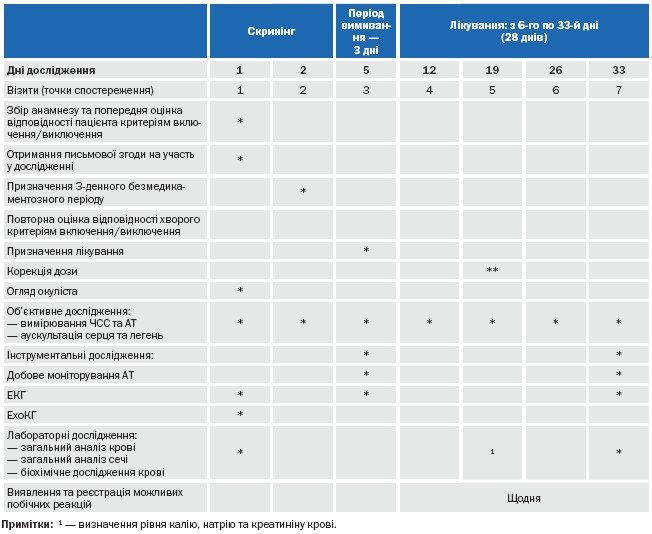
Згідно протоколу, усім пацієнтами були проведені наступні дослідження: збір анамнезу, вимірювання маси тіла та зросту, об’єктивне обстеження, вимірювання офісного САТ та ДАТ, частоти серцевих скорочень (ЧСС), біохімічне дослідження крові, загальноклінічні дослідження крові та сечі, тест на вагітність для жінок фертильного віку, електрокардіографія (ЕКГ), добове моніторування АТ (ДМАТ), огляд окуліста, визначення виразності клінічних симптомів, реєстрація побічних явищ, оцінка ефективності лікування, контроль за виконанням режиму прийому препаратів (таблиця 1).
Вимірювання АТ проводили ртутним сфігмоманометром вранці між восьмою та десятою годинами на всіх етапах дослідження (таблиця 1). Реєстрацію САТ та ДАТ в положенні сидячи проводили на одній і тій же руці два рази з інтервалом у дві хвилини, якщо величини АТ не різнилися більш як на 5 мм рт. ст. [21]. При виявленні більшої різниці між отриманими величинами – проводили третє вимірювання та обчислювали середнє значення з двох або трьох послідовних вимірювань. ЧСС визначали після другого вимірювання.
Реєстрацію електрокардіограми до, на 6-му тижні та в кінці лікування проводили на шести канальному самописці “Юнікард” (Україна). Визначали наявність загальноприйнятих ознак гіпертрофії лівого шлуночка (індекс Соколова, індекс Корнела, тривалість Корнела) та порушення серцевого ритму.
ДМАТ проводили на портативному апараті АВРМ-04 (“Метідек”, Угорщина) на етапі в кінці відмивання, на 6-му тижні та в кінці періоду лікування. При цьому, вивчали наступні показники: середньодобовий (т), денний (д), нічний (н) та максимальний (Мак.) систолічний АТ (САТ), середньодобовий, денний, нічний та максимальний діастолічний АТ (ДАТ), ЧСС [25]. Також, визначали індекс варіабельності (Ст. від.) [25]. Крім того, за допомогою програмного забезпечення апарату вираховували добовий індекс (ДІ) – відсоток зниження нічного АТ у порівнянні із денним. Моніторування проводили в наступному режимі: у денний час – кожні 15 хви¬лин, уночі (з 22.00 до 6.00 годин) – кожні 30 хвилин. Хворі вели звичайний спосіб життя, виконуючи побутові фізичні і психоемоційні навантаження [25].
Таблиця 1. Протокол дослідження
- Отримання інформованої згоди пацієнта;
- Медична амбулаторна карта пацієнта;
- Фізікальне обстеження;
- Дані об’єктивного дослідження (АТ, ЧСС, температура тіла);
- Попереднє та супутнє лікування;
- Перевірка відповідності критеріям включення/виключення в дослідженні.
Біохімічні аналізи виконувалися на автоматичному біохімічному аналізаторі “А-25” (виробник Франція) в ДУ «ННЦ «Інститут кардіології імені академіка М.Д.Стражеска» НАМН України до та в кінці дослідження. Визначали рівень білірубіну, креатинину, калію, натрію, тригліцеридів, загального білку, АЛТ, АСТ, сечової кислоти, глюкози та холестерину сироватки крові. Тест на вагітність проводили жінкам фертильного віку за допомогою смужкового тесту.
Оцінку ефективності лікування проводили на основі динаміки АТ (офісного та добового), а також суб’єктивних скарг хворого. Головними критеріями ефективності були: зниження офісного САТ не менше, ніж на 20 мм рт.ст. та ДАТ не менше, ніж на 10 мм рт.ст. або досягнення цільового рівню САТ/ДАТ (менше 140/90 мм рт.ст.). Вторинними критеріями ефективності були: зниження середніх значень САТ і ДАТ за 24 години, у період сну та в денний період. Переносимість лікарського препарату оцінювали за шкалою:
– добра (при об’єктивному обстеженні в динаміці не виявляються які-небудь патологічні зміни або клінічно значущі відхилення, дані лабораторного обстеження достовірно не змінюються і не виходять за межі норми, пацієнт не відмічає побічних реакцій);
– задовільна (при обстеженні в динаміці виявляються незначні зміни, які носять транзиторний характер та не потребують додаткових медичних втручань або зміни схеми лікування, дані лабораторних досліджень відхиляються від норми незначно, спостерігаються незначні побічні явища, що викликають у пацієнта серйозних проблем та не потребують відміни препарату);
– незадовільна (при обстеженні в динаміці виявляються патологічні зміни, що потребують відміни препарату та проведення додаткових медичних втручань, дані лабораторних обстежень є клінічно значущими та потребують додаткового обстеження, має місце небажана побічна дія, яка значно негативно впливає на стан пацієнта та потребує відміни препарату і проведення додаткових медичних втручань.
Враховували та оцінювали у балах ступінь виразності таких ознак (суб’єктивних скарг): головний біль, запаморочення, порушення сну, галюцинації/депресія, слабкість м’язів, діспептичні явища (діарея, запор, нудота, болі в животі), задишка, ортостатична гіпотензія, порушення зору, набряки та інші, вказані в індивідуальній карті пацієнта. Ступінь виразності скарг визначався за бальною системою: 0- відсутність скарг, 1 – незначна виразність скарг, 2 – помірна виразність, 3- значна виразність.
Усі дослідження проводилися після 3-денної відміни антигіпертензивних препаратів, які пацієнт отримував до включення у дослідження, та через місяць лікування. Контроль офісного АТ та реєстрація побічних явищ проводилася на кожному етапі обстеження.
До початку дослідження всім пацієнтам відміняли на 3 дні антигіпертензивну терапію, після чого проводили лабораторно-інструментальні дослідження. Тривалість періоду відміни була визначена виходячи з того, що більшість препаратів мають період напіввиведення 12-24 години і вони повністю зникають з крові протягом в середньому 48-72 годин. При підвищенні АТ в період відміни медична допомога надавалася пацієнту згідно п.16 Наказу №24 від 17.01.05 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Медицина невідкладних станів».
Пацієнтам основної групи (n=45) призначали препарат «Ірбетан-Н», таблетки виробництва ПАТ «Київський вітамінний завод» . Препарат призначався по 1 таблетці (300 мг ірбесартану+12,5 мг гідрохлортіазиду) один раз на добу, вранці. Курс лікування складав 28 днів. Препарат пацієнт приймав в один і той же час. Таблетки приймалися цілими та запивалися невеликою кількістю рідини під час або зразу після прийому їжі. Курс прийому склав 28 днів. Пацієнти контрольної групи (n=45) отримували за аналогічною схемою зареєстрований в Україні референтний препарат «Ко-апровель® (300 мг ірбесартану+12,5 мг гідрохлортіазиду) виробництва фірми «Sanofi Winthrop Industrie», Франція.
Під час дослідження не дозволявся прийом інших антигіпертензивних препаратів, великої кількості рідини, нестероїдних та стероїдних протизапальних препаратів, симпатомиметичних препаратів, індукторів мікросомального окислення. При кожному візиті проводився контроль прийому ліків, підраховували кількість прийнятих пацієнтом таблеток та кількість днів, що пройшло від попереднього візиту. Якщо коефіцієнт прихильності до лікування (кількість випитих таблеток/кількість днів прийому) був менше 0,75 пацієнт виключався із дослідження.
Статистичну обробку результатів проводили після створення баз даних у системах Microsoft Excel. Середні показники обстежених пацієнтів визначали за допомогою пакету аналізу у системі Microsoft Excel. Усі інші статистичні розрахунки проводили за допомогою програми SPSS 13.0. Нормальність рядів визначалася за допомогою критерію Шапіро-Уілка. При нормальному розподілі достовірність різниці середніх на етапах лікування визначалася за допомогою парного двовідбіркового тесту, достовірність різниці між групами за допомогою незалежного t-тесту для середніх після визначення характеру розподілу показників. Ефективність у групах та різниця у групах за розподілом наявності тої або іншої ознаки оцінювалася за дихометричною перемінною за допомогою критерію χ2.
Результати
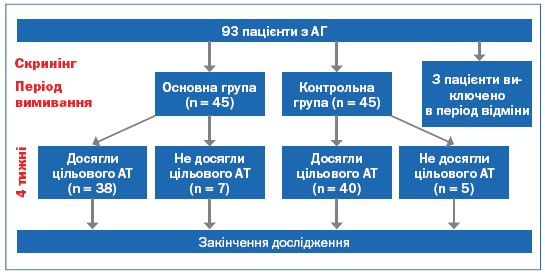
У дослідження було рандомізовано 90 пацієнтів з другим та третім ступенем підвищення АТ. Ще 3 пацієнти було виключено на етапі до рандомізації – у них відмічалося значне підвищення АТ у період відмивки, що потребувало призначення комбінованої антигіпертензивної терапії. Побічні явища виникли у 3 (6,7%) пацієнтів основної групи та у 2 (4,4%) контрольної групи. Проте, жодного пацієнта після рандомізації із дослідження виключено не було. В аналіз кінцевої ефективності терапії було включено 45 та 45 пацієнтів відповідно основної та контрольної груп. Загальна клініко-демографічна характеристика пацієнтів, включених у дослідження представлена у таблиці 2.
Таблиця 2. Клініко-демографічна характеристика обстежених груп хворих.
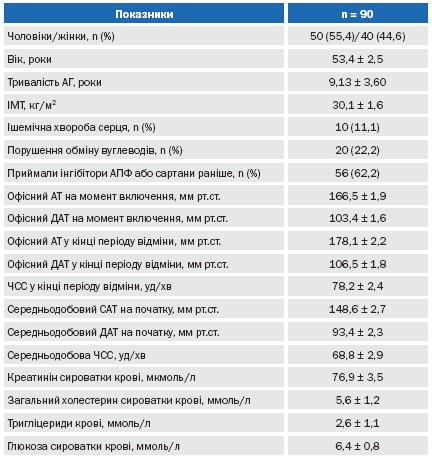
Як видно з таблиці 2, у дослідженні приймала участь майже однакова кількість жінок та чоловіків, які у більшості своїй мали досвід прийому інгібіторів АПФ, середнім віком 53,4±2,5 років, що мали переважно надлишкову масу тіла та порушення ліпідного обміну. Окрім того, 11,1%, включених у дослідження пацієнтів мали ішемічну хворобу серця та 22,2% порушення вуглеводного обміну (підвищений рівень глюкози натще, цукровий діабет, знижена толерантність до глюкози при проведені глюкозо-толерантного тесту). Середній рівень АТ в кінці періоду відмивання відповідав критеріям включення. Середньодобовий САТ і ДАТ також були підвищеними у відповідності до ступеню АГ.
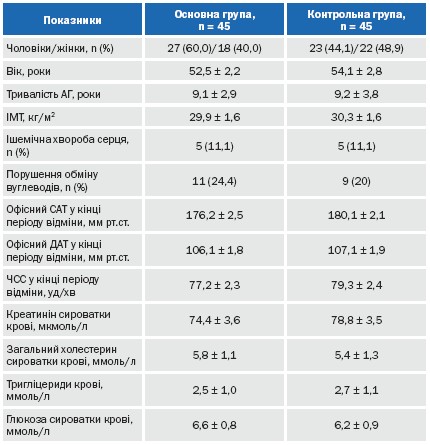
Пацієнтам обох груп було проведено фізикальне обстеження, офісне вимірювання АТ, ДМАТ, ЕКГ. Клініко-демографічна характеристика рандомізованих груп пацієнтів представлена у таблиці 3. Як видно з таблиці 3, на початку дослідження групи пацієнтів, що порівнювалися, достовірно не відрізнялися за основними клініко-демографічними показниками.
В обох групах переважали хворі із надмірною масою тіла, підвищеним рівнем загального холестерину та тригліцеридів сироватки крові. В обох групах 11,1% пацієнтів мали ішемічну хворобу серця та більше 20% пацієнтів відмічалося порушення обміну глюкози (або цукровий діабет, або порушення толерантності до глюкози, або підвищений рівень глюкози натще). Тобто, як мінімум кожен п’ятий пацієнт відносився за рівнем ризику до групи дуже високого ризику виникнення серцево-судинних ускладнень. Групи достовірно не відрізнялися за рівнем АТ.
Рисунок 1. Схема призначення лікування
Таблиця 3. Клініко-демографічна характеристика обстежених груп хворих.
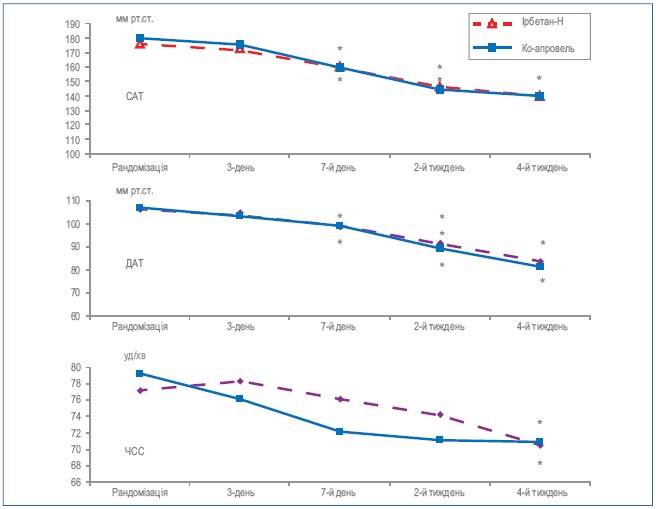
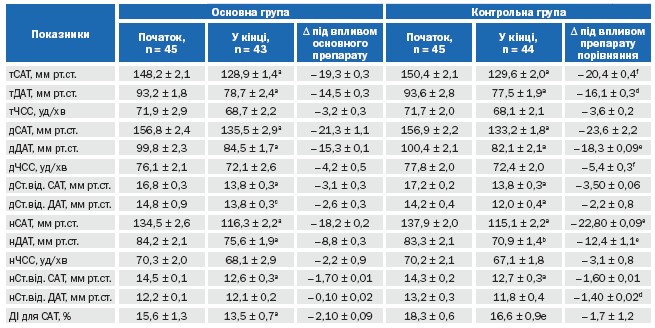
Під впливом призначеної додаткової терапії спостерігалося достовірне зниження рівню офісних САТ, ДАТ та ЧСС в обох групах. Ці дані представлено на рисунку 2 та в таблиці 4. Як видно з них, в середньому після рандомізації офісний САТ знизився з 176,2 ± 2,5 до 139,9±2,5 мм рт. ст. (Р < 0,001) у 1-й групі та з 180,1 ± 2,1 до 139,9±2,2 мм рт. ст. (Р < 0,001) у 2-й групі. Рівень ДАТ відповідно знизився з 106,1 ± 1,8 до 83,7±1,2 мм рт. ст. (Р < 0,001) та з 107,1 ± 1,4 до 82,3±1,4 мм рт. ст. (Р < 0,001). При цьому, достовірне зниження офісного САТ/ДАТ і в контрольній групі, і в основній групах відбувалося вже на 7 дні прийому препарату. За ступенем зниження офісного САТ і ДАТ, контрольний препарат був незначно, але достовірно більш ефективний на етапах лікування. Проте, це пояснювалося більш високим рівнем АТ в групі порівняння на початку дослідження, адже за рівнем досягнутого АТ групи достовірно не відрізнялися на відповідних етапах лікування.
Офісна ЧСС достовірно зменшилася в обох групах із 77,2 ± 2,3 та 79,3 ± 2,4 уд. за хв. на початку дослідження та 70,5 ±1,9 та 70,9±1,9 уд. за хв. в кінці дослідження відповідно в першій та другій групах (Р< 0,05 та 0,01 відповідно). За ступінню зменшення ЧСС групи достовірно не відрізнялися. Зниження ЧСС у нашому дослідженні підтверджує дані літератури щодо антисимпатичної дії блокаторів ренін-ангіотензинової системи.
Загалом, цільовий офісний АТ було досягнуто у 38 (84,4%) та 40 (88,9%) пацієнтів на етапі 4 тижні лікування відповідно в основній та контрольній групах (Р=НД). Доля хворих, у яких офісний САТ/ДАТ достовірно знизився на > 20/10 мм рт.ст. склала відповідно в першій та другій групі – 95,6 % (n=43) та 97,8% (n=44), P=НД. Тобто, обидва препарати були однаково ефективними щодо зниження офісного АТ при 4-тижневому прийомі. Cтупінь зниження АТ був співставний з даними літератури для комбінованих препаратів [7, 17, 18, 20, 22].
Рисунок 2. Динаміка офісних САТ, ДАТ та ЧСС на фоні прийому препаратів, що порівнювалися
Результати ДМАТ представлено у таблиці 5. Як видно з таблиці 5, на початку дослідження, як і слід було очікувати, тСАТ і тДАТ були меншими, ніж офісні показники, і групи достовірно не відрізнялися між собою як за показниками на початку дослідження, так і на етапі рандомізації. На фоні призначеного лікування спостерігалося достовірне зниження середньодобових САТ/ДАТ, денних САТ/ДАТ та нічних САТ/ДАТ в обох групах. Ступінь зниження середньодобових САТ/ДАТ, денних САТ/ДАТ та нічних САТ/ДАТ склала – 19,3/14,5, 21,3/15,3, 18,2/8,8 та 20,4/16,1, 23,6/18,3 та 22,8/12,4 мм рт.ст. відповідно в першій та другій групах (Р=0,05/0,001, Р=НД/0,005, Р=0,02/0,02).
Як видно у другій групі призначений референтний препарат був більш ефективним щодо ступеню зниження АТ, виміряного при добовому моніторуванні. Проте, це можна дещо пояснити більшим рівнем САТ і ДАТ на початку дослідження у другій групі, адже за досягнутими рівнями САТ і ДАТ групи достовірно не відрізнялися. Варіабельність дСАТ/ДАТ та нСАТ достовірно знизилася в обох групах. Проте, ступінь зниження нДАТ за рахунок більш високих початкових показників була достовірно більшою у групі референтного препарату. За даними літератури зменшення варіабельності АТ можна вважати позитивною рисою лікування, адже підвищена варіабельність асоціюється з більшою частотою виникнення несприятливих подій [25]. Середній ДІ на початку дослідження був у межах норми в обох групах. На фоні лікування він достовірно зменшився у першій групі, але в межах нормальних показників і залишався більш низьким, ніж у групі референтного препарату. За величиною ДІ доля хворих, що характеризувалися як «нон-діппер» склала – 15 (33,3%) та 11 (24,4%) відповідно в першій та другій групах (Р=НД). На фоні лікування вона зменшилася, але недостовірно в обох групах і склала відповідно – 12 (26,7 %) та 10 (22,2%), Р=НД. Загалом, цільовий середньодобовий АТ (< 130/80 мм рт.ст.) було досягнуто у 25 (55,6%) пацієнтів 1-ї групи та у 27 (60,0%) пацієнтів 2-ї групи (різниця недостовірна). Менший відсоток пацієнтів, що досягли цільового АТ за даними ДМАТ, є цілком закономірним. Адже відомо за даними літератури, що ефективність антигіпертензивної терапії значно менша, якщо її оцінювати за допомогою методу ДМАТ у порівнянні із офісним вимірюванням [25]. тЧСС, дЧСС та нЧСС достовірно та в більшому ступені знизилася лише у другій групі.
У нашому дослідженні не спостерігалося достовірної зміни показників ЕКГ (таблиця 6). Ми не відмітили достовірної зміни загально клінічних та біохімічних показників, що вивчалися (таблиця 7), що свідчило про метаболічну нейтральність даних препаратів. Спостерігалося в обох групах тенденція до зменшення рівню загального холестерину та глюкози в обох групах.
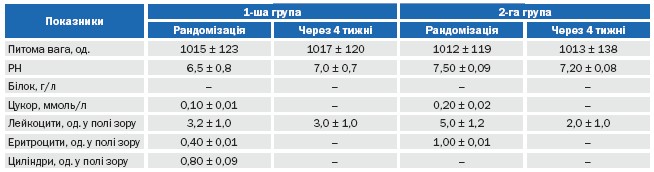
Ми не спостерігали значних та достовірних змін в аналізі сечі в жодній із груп обстежених пацієнтів (таблиця 8).
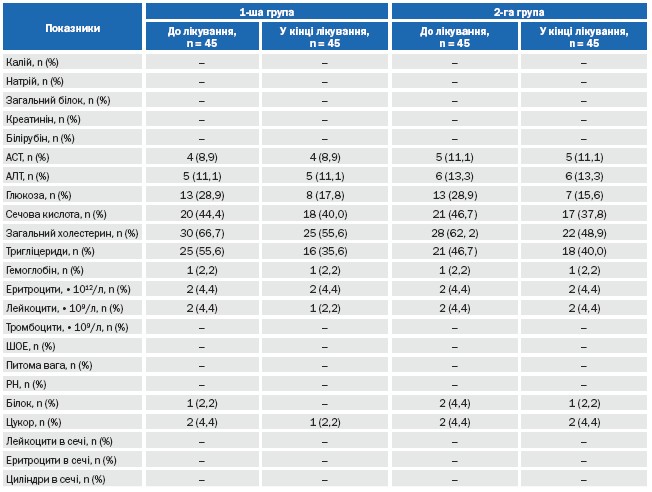
Розподіл пацієнтів в залежності від лабораторних показників (з відхиленням від норми та без) до та в кінці лікування представлено у таблиці 9. Як видно з таблиці 9, на фоні лікування в обох групах достовірно не змінилися кількість та доля пацієнтів, що мали відхилення лабораторних показників. Спостерігалася тенденція до зменшення долі пацієнтів з відхиленням рівню глюкози сироватки крові. Групи достовірно не відрізнялися за долею пацієнтів з відхиленнями лабораторних показників між собою на етапах лікування.
Таблиця 4. САТ, ДАТ та ЧСС у групах, що порівнювалися на етапах лікування (М±m)
.jpg)
Примітки: вірогідність показника порівняно з 1-ю групою на відповідному етапі лікування: a — Р < 0,001; b — P < 0,005; c — P < 0,05; вірогідність різниці порівняно з початком в одній і тій самій групі: d — P < 0,001; e — P < 0,02; f — P< 0,05; вірогідність різниці порівняно з етапом 7 днів в одній і тій самій групі: g — P < 0,001.
Таблиця 5. Динаміка показників добового моніторування артеріального тиску на фоні лікування в залежності від прийому антигіпертензивного препарату
Примітки: вірогідність показника у групі порівняно з початком: a — Р < 0,001; b — Р < 0,02; c — Р < 0,05; вірогідність різниці порівняно з 1-ю групою: d — P < 0,001; e — P < 0,02; f — P < 0,05.
Таблиця 6. Динаміка показників ЕКГ у групах обстежених пацієнтів
Таблиця 7. Динаміка показників загально клінічного та біохімічного аналізу крові на фоні лікування у хворих обстежених груп
Таблиця 8. Динаміка показників загального аналізу сечі
Динаміка виразності суб’єктивних скарг хворих у групах представлена у таблиці 10. Як видно з таблиці 10, в обох групах достовірно зменшилася виразність таких симптомів, як головний біль (перш за все, за рахунок зменшення АТ), запаморочення, підвищена втомлюваність, задишка, нудота (за рахунок зниження АТ та зменшення піків підйому АТ), слабкість та порушення сну. Розподіл пацієнтів в залежності від наявності в них скарг на етапах лікування представлено на рисунку 3. Як видно з рисунку 3, лікування і «Ірбетан-Н», і «Ко-апровель®» призводило, до значного та достовірного зменшення долі пацієнтів з наявністю скарг. Групи достовірно не відрізнялися між собою за частотою, з якою зустрічалася та або інша скарга у обстежених пацієнтів та суттєво не відрізнялися за динамікою зміни частоти, з якою зустрічалися скарги.
Таблиця 9. Динаміка на фоні лікування змін кількості та частки пацієнтів, що мали відхилення лабораторних показників
Примітки: (–) — відсутність пацієнтів із відхиленнями даного показника у групі.
Таблиця 10. Динаміка виразності скарг (у балах) хворих у групах, що порівнювалися
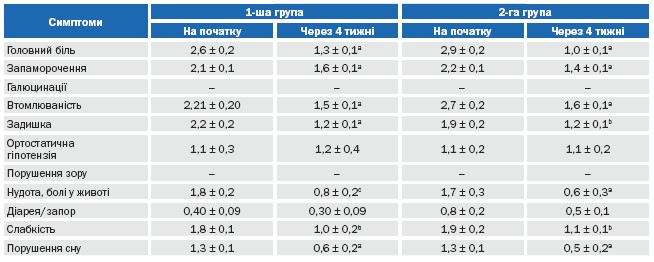
Примітки: a — вірогідність показника у групі порівняно з початком Р < 0,001; b — вірогідність показника у групі порівняно з початком Р < 0,005; c — вірогідність показника у групі порівняно з початком Р < 0,02.
Рисунок 3. Розподіл пацієнтів в залежності від наявності скарг на етапах
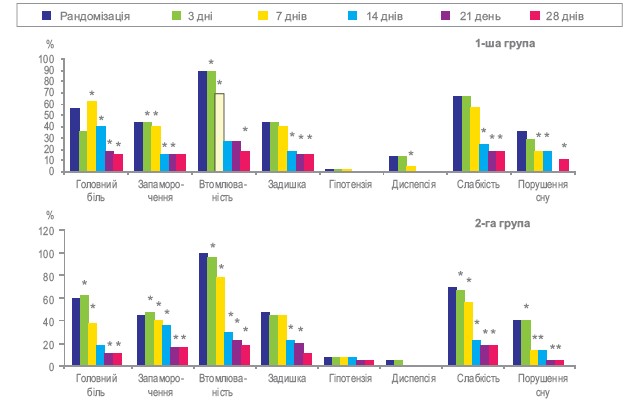
Примітка: * — вірогідно порівняно з початком.
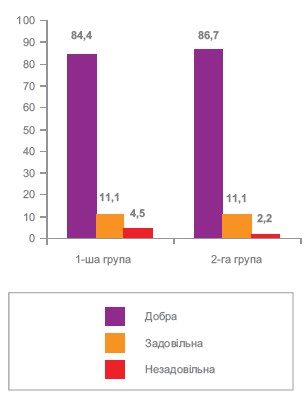
Оцінка переносимості препаратів, що порівнювалися представлена на рисунку 4. Як видно з рисунка 4, 43 (95,6%) пацієнтів першої групи та 44 (97,8%) другої групи добре або задовільно переносили призначене лікування – з них 38 (84,4%) та 39 (86,7%) пацієнтів відповідно першої та другої групи мали добру переносимість.
Рисунок 4. Оцінка переносимості препаратів, що порівнювалися.
Побічні явища виникли у 3 (6,7%) пацієнтів основної групи та у 2 (4,4%) контрольної групи (Р=НД). У 1-й групі: у всіх 3 пацієнтів (6,7%) була зареєстрована головна біль, яка, вірогідно, була пов’язана із недостатнім контролем АТ у перші дні лікування основним препаратом (пацієнт К.І.П. № 21 49 років, пацієнтка М.В.А. № 27 61 рік, пацієнтка М.Ю.І. №29 53 роки). У другій групі у 1 пацієнтки виникла головна біль (пацієнтка С.О.В. № 44 50 років) і у 1 пацієнта спостерігалося запаморочення (пацієнт П.В.П. № 30 47 років) Жоден із включених у дослідження пацієнтів не потребував відміни антигіпертензивних препаратів, що призначалися.
Таким чином, частота виникнення побічних реакцій в обох групах достовірно не відрізнялася між собою і була співставна з даними літератури [17, 18, 20, 22].
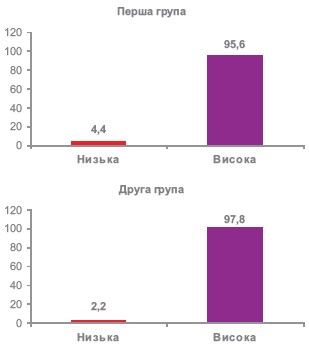
Як вказувалося вище, цільовий офісний АТ було досягнуто у 38 (84,4%) та 40 (88,9%) пацієнтів на етапі 4 тижні лікування відповідно в основній та контрольній групах (Р=НД). Доля хворих, у яких офісний САТ/ДАТ достовірно знизився на > 20/10 мм рт.ст. склала відповідно в першій та другій групі – 95,6 % (n=43) та 97,8% (n=44), P=НД. Тобто, первинна кінцева точка була досягнута у переважної більшості пацієнтів, включених у дослідження. Таким чином, висока ефективність була відзначена у 95,6% та 97,8% хворих (Р=НД) (рисунок 5).
Рисунок 5. Оцінка ефективності лікування у хворих обстежених груп (в балах)
Таким чином, застосування препарату «Ірбетан-Н», таблетки, виробництва ПАТ “Київський вітамінний завод», ефективно знижувало АТ, виміряного як в офісі, так і при ДМАТ. Препарат, що досліджувався, достовірно не відрізнявся за своєю антигіпертензивною ефективністю від препарату порівняння «Ко-апровель®», таблетки, виробництва компанії «Sanofi Winthrop Industrie» (Франція). Зниження АТ на фоні прийому обох препаратів супроводжувалося достовірним зменшенням варіабельності АТ. Терапія обома препаратами була метаболічно нейтральною та добре переносилась хворими.
Висновки
- Препарат «Ірбетан-Н» виробництва ПАТ “Київський вітамінний завод” (Україна) характеризувався достовірним та ефективним зниженням рівнів офісних САТ, ДАТ відповідно на 36,3, 22,4 мм рт. ст., що було еквівалентно зниженню офісного САТ і ДАТ на фоні лікування препаратом «Ко-апровель®» виробництва компанії «Sanofi Winthrop Industrie» (Франція) – 40,2, 25,8 мм рт. ст. За рівнем досягнутого АТ групи достовірно не відрізнялися. Цільовий офісний АТ було досягнуто у 84,4% пацієнтів, що отримували «Ірбетан-Н» протягом 4 тижнів та у 88,9% пацієнтів, що отримували препарат «Ко-апровель®» . Доля хворих, у яких офісний САТ/ДАТ достовірно знизився на > 20/10 мм рт.ст. склала відповідно в першій та другій групі – 95,6 та 97,8% (P=НД).
- На фоні лікування в обох групах спостерігалося достовірне еквівалентне зниження рівнів середньодобових, денних, нічних САТ/ ДАТ відповідно у групі «Ірбетан-Н» на 9,3/14,5, 21,3/15,3, 18,2/8,8 мм рт. ст., а у групі «Ко-апровель®» – на 20,4/16,1, 23,6/18,3 та 22,8/12,4 мм рт. ст. В кінці дослідження групи достовірно не відрізнялися між собою за рівнем досягнутого АТ. Цільовий середньодобовий АТ (< 130/80 мм рт.ст.) було досягнуто у 55,6% пацієнтів 1-ї групи та у 60,0% пацієнтів 2-ї групи.
- Висока антигіпертензивна ефективність препаратів, що порівнювалися, підтверджувалася достовірним зменшенням підвищеної варіабельності денного та нічного САТ.
- Обидва препарати характеризувалися низькою частотою виникнення побічних реакцій (6,7% у групі «Ірбетан-Н» та 4,4% у групі «Ко-апровель®»), були метаболічно нейтральними та добре переносилися хворими. За переносимістю препарати достовірно не відрізнялися між собою.
Література
- Артеріальна гіпертензія – медико-соціальна проблема / В.М. Коваленко, М.І. Лутай, Є.П. Свіщенко, Ю.М. Сіренко, І.П. Смірнова – К.: Інститут кардіології ім. М.Д. Стражеска АМН України, 2002. – 102 с.
- Горбась І.М. Контроль артеріальної гіпертензії серед населення: стан проблеми за даними епідеміологічних досліджень // Укр. кардіол. журнал. − 2007. – № 2. − С. 21-26.
- Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія». Наказ МОЗ України №384 від 24.05.2012.//Київ, 2012. – 107 с.
- Рекомендації Українського товариства кардіологів з профілактики та лікування артеріальної гіпертензії. Київ: Віпол, 2008 – 83 с.
- 2007 European Society of Hypertension – European Society of Cardiology guidelines for management of arterial hypertension // J.Hypertension.- 2007.- Vol. 25.- P. 1105-1187
- 2013 ESH/ESC Guidelines for the management of arterial hypertension TheTask Force for the management ofarterial hypertension of the European Society ofHypertension (ESH) and of the European Society of Cardiology (ESC)// Journal of Hypertension.- 2013. – Vol. 31. – P.1281–1357
- Arhofer K.G., Muenzel F., Krekler M. Effect of the Angiotensin Receptor Blocker Irbesartan on Metabolic Parameters in Clinical Practice: the DO-IT Prospective Observational Study // Cardiovasc. Diabetol. – 2007. — 6(1). – P. 36.
- Basta E., Barkis.G. Сhoices and goals in the treatment of diabetic hypertensive patients//Curr. Hypert. Rep. – 2001. – Vol. 3. – P. 387-391
- Bonds D., Palla S., Bertoni A. et al. Hypertension Treatment in the Ambulatory Setting: comparison by race and gender in a National survey//J. Clin. Hypertens. – 2004. – Vol.6. – P.223-230.
- Bramlage P; Durand-Zaleski I; Desai N; Pirk O; Hacker C The value of irbesartan in the management of hypertension// Expert Opin Pharmacother. – 2009.- Vol. 10. – P.1817-31 (ISSN: 1744-7666)
- Burt V.L., Cutler J.A., Higgins M. et al. Тrends in the prevalence, awareness, treatment and control of hypertension in the adult US population. Data from the health examination surveys 1960-1991//Hypertens. – 1995. – Vol.26. – P.60-65.
- Chatellier G., Menard J., Devries C. et al. Blood pressure control in hypertension center//J.Hypertens. – 1987. – Vol. 5. – P.47-49S.
- Elliot H., Connel J., McInnes G. The Year in hypertension. – Clinical Publishing Services Ltd: Oxford, 2001. – 369 p.
- Fogari R, Ambrosoli S, Corradi L, et al. 24-hour blood pressure control by once-daily administration of irbesartan assessed by ambulatory blood pressure monitoring: Irbesartan Multicenter Investigators’ Group. //J Hypertens.- 1997. – Vol.15. – P.1511–1518.
- Havranek EP, Thomas I, Smith WB, et al. Dose-related beneficial long-term hemodynamic and clinical efficacy of irbesartan in heart failure// J Am Coll Cardiol. – 1999. – Vol.33. – P.1174–1181.
- Hypertension Primer. The essentials of high blood pressure. Basic science. Population science and clinical management. Fourth edition. From the council on high blood pressure research American Heart Association. – Lippincott Williams & Wilkins: Dallas, 2008. – 610 p.
- Kintscher U., Bramlage P., Paar W.D. et al. Irbesartan for the treatment of hypertension in patients with the metabolic syndrome: a sub analysis of the Treat to Target post authorization survey. Prospective observational, two armed study in 14,200 patients // Cardiovasc. Diabetol. – 2007. – 6. — P. 12
- Lewis E.J., Hunsicker L.G., Clarke W.R. et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes // N. Engl. J. Med. – 2001. -345. – P. 851–860
- Mancia G., Sega R., Milesi C. et al. Blood pressure control in the hypertensive population//Lancet. – 1997. – Vol.348. – P.454-457.
- Massie B.M., Carson P.E., McMurray J.J. et al. Irbesartan in patients with heart failure and preserved ejection fraction// N Engl J Med. – 2008. – Vol.359. – P.172
- Moser M. Clinical management of Hypertension. Fourth Edition. Caddo: Professional Communications, Inc., 1999. – 240 p.
- Parving H. H., Lehnert H., Brochner-Mortensen J. et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes // N. Engl. J. Med. – 2001. – 345. – P. 870-8.
- The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. US Department of Health and Human Service. NIH Publication No. 03-5233, 2003. – 34 p.
- Urata H., Healey B., Stewart R. W., Bumpus F. M., Husain A., Angiotensin II-Forming Pathways in Normal and Failing Human Hearts //Cirs Res. -1990. – Vol. 66. – P. 883-90.
- White W. Blood pressure monitoring in Cardiovascular Medicine and Therapeutics. – N. Jersy: Humana Press, 2001. – 308 p.
Стаття надана мовою оригіналу





