
 Article
Article
 03.03.2025
03.03.2025
Практика использования Эпадола Нео во вторичной профилактике внезапной сердечной смерти у больных с постинфарктным кардиосклерозом и стабильным течением ишемической болезни сердца на основе его антиаритмической и гиполипидемической эффективности.
Кардашевская Л.И., Михайличенко Е.С. Кафедра внутренней медицины №1, Донецкий национальный медицинский университет им. Горького, г. Донецк, Украина
Реферат
Цель. Оценить эффективность использования ЭпадолНео производства «Киевский витаминный завод» (Украина) в дозе 2 грамма в сутки при желудочковых нарушениях ритма (ЖНР) высоких градаций у больных стабильной ишемической болезнью сердца (ИБС), дислипидемией и умеренно выраженной хронической сердечной недостаточностью (ХСН) в качестве дополнения к базовой терапии у постинфарктных больных с целью вторичной профилактики внезапной сердечной смерти (ВСС). Исследование открытое.
Материал и методы. Наблюдались 48 больных ИБС (30 мужчин, 18 женщин, средний возраст 58,2±5,3 года (М±SD) с постинфарктным кардиосклерозом и стабильной стенокардией 2-3 ФК, ХСН 2-3 класса по NYHA и ФВ ≥45 %, с желудочковыми экстрасистолами (ЖЭ) высоких градаций, выявленных при холтеровском мониторировании (ХМ) ЭКГ и дислипидемией, в том числе гипертриглицеридемией (гипер-ТГ) у ⅓ пациентов. В дополнение к основному лечению пациенты получали 2 грамма Эпадола Нео в течение 1-го года. Мониторирование ЭКГ с оценкой аритмий и вариабельности ритма сердца (ВРС) и исследование липидограммы проводились исходно, через 3 месяца и 1 год, ЭхоКГ проводили исходно и через 1 год.
Результаты. За время наблюдения ни один пациент не был госпитализирован по поводу декомпенсации ХСН или ИБС, все живы, никто из исследования не выбыл. Переносимость эпадола была хорошей; неблагоприятных эффектов, потребовавших его отмены, не отмечено.
Через 3 месяца от начала терапии Эпадолом-Нео среднесуточное значение ЧСС снизилось на 4,2% (р<0,05). Анализ изменений количества эпизодов наджелудочковых НРС выявил следующее: после 3-х месячной терапии Эпадолом-Нео количество НЖЭ снизилось на 18,0 % (р<0,05), эпизодов аллоритмии (би- и тригеминии) на 50 % (р<0,05).
Динамика выраженности ЖНР на фоне приема Эпадола Нео характеризовалась тем, что уже через 3 месяца терапии количество ЖЭ 1-го и 2-го классов по Ryan снизилось на 33% (р<0,05), эпизодов аллоритмий – на 50% (р<0,05), при уменьшении эпизодов ЖТ в 2 раза и значительном уменьшении эпизодов политопных и парных ЖЭ – на 40 % (р<0,05).
Удлинение сроков лечения больных до 1 года привело к усилению антиаритмического эффекта Эпадола Нео на желудочковую (в большей степени), и наджелудочковую ЭС. Количество НЖЭ уменьшилось на 52 % (р<0,05), в том числе количество пароксизмов ФП снизилось на 67 % (р<0,05). Интересно, что наджелудочковая и желудочковая эктопическая активность менялась в большей степени у пациентов с исходной гипертриглицеридемией.
Продолжение приема препарата в течение 1 года сопровождалось дальнейшим снижением количества ЖНР. В итоге ЖЭ 1-го и 2-го классов по Ryan снизились на 57,5%, 3-го и 4-го классов (парные, политопные ЖЭ) – на 70 %, а пароксизмы ЖТ наблюдались только у 1-го больного, то есть количество их снизилось более, чем на 90 % при р<0,05.
Исходные показатели ВРC были низкими: SDNN 114,12±24,82, а показатель LF/HF значительно превышал 1,0 (4,34±0,44), что указывало на преобладание симпатической активности над парасимпатической и выраженный дисбаланс автономной нервной системы. Через 1 год наблюдения произошло достоверное увеличение SDNN на 20 % на фоне уменьшения желудочковой эктопической активности и снижение индекса LF/HF с нормализацией его у 38 % пациентов (1,1±0,77), что можно расценивать как положительную реакцию. ФВ по данным ЭхоКГ через год на фоне комбинации стандартной терапии и Эпадола Нео увеличилась недостоверно и в среднем составила 50,2±4,6 %. Через 3 месяца от начала приема Эпадола Нео ТФН по результатам лестничных проб увеличилась недостоверно, однако через год произошло достоверное уменьшение количества пациентов с низкой ТФН с одновременным увеличением числа пациентов с высокой ТФН.
Что касается липидного профиля, то на фоне присоединения к статинам Эпадола Нео наблюдалась дополнительная положительная динамика: если через 3 месяца показатели липидного профиля (ОХС, ЛПНП, ЛПВП) не изменились, за исключением ТГ и ЛПОНП (достоверное снижение на 22,3 % и на 10 % соответственно), то через 1 год произошло снижение уровня ОХС на 11,4 % и ЛПНП на 9,1 %, хотя и статистически незначимое, а также достоверное снижение уровня ЛПОНП на 15 % (р<0,05) и ТГ на 34,8 % (р <0,05). Через 1 год у 92 % пациентов уровень ТГ был менее 1,7 ммоль/л.
Заключение. Назначение препарата Эпадол-Нео производства «Киевский витаминный завод» (Украина) в дозе 2 грамма в сутки больным со стабильной ИБС и постинфарктным кардиосклерозом с ХСН 2-3 ФК по NYHA и ФВ ≥45 % и ЖЭ высоких градаций по М. Ryan приводит к значительному уменьшению выраженности жизнеопасных аритмий, увеличению ВРС, уменьшению симпатического дисбаланса, а значит, уменьшению электрической нестабильности миокарда и риска внезапной сердечной смерти. Добавление Эпадола Нео приводит к дополнительному улучшению липидного профиля за счет уменьшения триглицеридов, ЛПОНП. Таким образом, эпадол-нео в дозе 2г/сутки целесообразно рекомендовать больным ИБС с постинфарктным кардиосклерозом и дислипидемией (особенно – гипертриглицеридемией), страдающими ЖНР высоких градаций, для длительного применения с целью вторичной профилактики внезапной сердечной смерти.
Введение. Удельный вес сердечно-сосудистых заболеваний (ССЗ), в частности, ИБС, в общей заболеваемости и смертности в Украине, довольно высок и преобладает над другими болезнями. Ежегодно в стране регистрируется порядка 50 тыс. инфарктов миокарда (ИМ). Согласно сердечно-сосудистому континууму, после перенесенного ИМ сохраняется опасность прогрессирования сердечной недостаточности (СН) и высокий риск ВCC даже при сохранной систолической функции миокарда. Так, при анализе РКИ MRFIT наиболее высокий удельный вес ВСС (≥ 60%) наблюдался у пациентов ИБС с ХСН II ФК, т.е. при сохранной систолической функции миокарда, тогда как более тяжелые пациенты с ХСН IV ФК погибали в основном от прогрессирующей СН. Таким образом, вторичная профилактика ВСС после перенесенного ИМ является актуальной проблемой.
Понятие внезапной смерти сегодня прочно связывается с ЖНР, а наличие ХСН по результатам Фремингемского исследования, увеличивает риск ВСС в 6-9 раз.
Все комментарии и оценки современных медикаментозных и немедикаментозных методов профилактики риска ВСС относятся в основном к пациентам с ХСН и/или дисфункцией левого желудочка.
Нет сомнений в том, что ЖНР играют важную роль в прогрессировании ХСН и могут быть причиной ВСС и больных с декомпенсацией. Доказана связь ЖЭ высоких градаций в возникновении жизнеопасных аритмий (ЖТ, фибрилляции желудочков – ФЖ), что позволяет считать их маркером риска ВСС у больных ИБС [5,6,7]. В структуре смертности больных с ХСН от 1/3 до 2/3 всех исходов трактуются как ВСС, поэтому важен поиск возможных подходов к специфическому влиянию на ЖНР и снижению риска смертности больных с ХСН. Наиболее перспективным в этом плане долгое время считалось применение β-адреноблокаторов (БАБ) и антиаритмических препаратов (ААП) (чаще всего амиодарона). Несмотря на многочисленные положительные данные РКИ по профилактике ВСС, к сожалению, все ААП обладают в разной степени выраженности аритмогенным действием. Врач должен взвешивать риск/пользу от любого препарата. В настоящее время наиболее эффективным в профилактике ВСС у постинфарктных больных является использование имплантируемого кардиовертера дефибриллятора (ИКД) [6]. Проаритмогенный эффект ААП, недостаточная эффективность БАБ и дороговизна ИКД требует поиска новых безопасных и доступных средств. К таковым относится применение ω-3 полиненасыщенных жирных кислот (ω-3 ПНЖК), поскольку в нескольких исследованиях было выявлено их положительное влияние на смертность от ССЗ. ω-3 ПНЖК (эйкозапентаеновая и доксозагексаеновая) обладают рядом благоприятных эффектов на течение ССЗ. Результаты проспективных когортных исследований, а также РКИ подтверждают клиническую значимость данных эффектов ω-3 ПНЖК (Harris S. 2007 г.).
Настоящей «бомбой» оказалось итальянское исследование GISSI Prevenzione, в котором на большом клиническом материале было показано, что дополнительное назначение 1 г в день ω-3 ПНЖК способствовало снижению общей смертности на 20%, сердечно-сосудистой – на 30% и риска ВСС – на 45%!, к тому же этот эффект наблюдался уже через 3-4 мес от начала лечения и усиливался с течением времени [23].
Анализ результатов РКИ показал, что влияние ω-3 ПНЖК на снижение смертности связано именно с уменьшением количества случаев ВСС.
Группа риска ВСС – это пациенты с коронарными событиями в анамнезе, низкой ФВ и ХСН, а также с клинической смертью в анамнезе. В итоге самый высокий риск ВСС прогнозируется у пациентов, перенесших ИМ, с низкой ФВ и ЖНР высоких градаций, в том числе с ЖТ. Среди препаратов, содержащих ω-3 ПНЖК, препарат КВЗ Эпадол-Нео представляет интерес для врачей-клиницистов. Обладает ли он такой же эффективностью, как очищенные ω-3 ПНЖК?
Цель исследования – Оценить эффективность использования Эпадола Нео производства «Киевский витаминный завод» (Украина) в дозе 2 грамма в сутки при ЖНР высоких градаций у больных стабильной ИБС, дислипидемией и умеренно выраженной ХСН в качестве дополнения к стандартной терапии у постинфарктных больных с целью вторичной профилактики ВСС. Исследование открытое.
Критерии включения: стабильныепациенты ИБС, перенесшие ИМ, имеющие дополнительные факторы риска (ФР): курение, артериальную гипертензию (АГ), дислипидемию, в том числе гипер-ТГ >1,7 ммоль/л, находящиеся на стандартной терапии не менее 3-х месяцев (бета-адрено-блокаторы или антагонисты кальция, нитраты, статины, АСК, ИАПФ), имеющие нарушения ритма в виде ЖЭ высоких градаций по данным ХМ ЭКГ (групповые, парные, политопные ЖЭ, пробежки ЖТ), достигшие целевой ЧСС 65-70 в мин. в покое, АД ≤140/90 мм рт.ст., ХСН не выше II-III ФК по NYHA с ФВ ≥45 %. Клиническая характеристика больных представлена в таблице 1.
Пациентам, удовлетворяющим критериям включения, предлагалось подписать информированное согласие.
Критерии исключения: В исследование не включались пациенты, которые имели пороки клапанов сердца, ХСН ≥III функционального класса (NYHA) c ФВ<45%, страдающие ХОБЛ в стадии обострения, почечную (скорость клубочковой фильтрации (СКФ) <60 мл/мин) или печеночную недостаточность (повышение уровня АЛТ в плазме крови в ≥2 раза), заболеваниями щитовидной железы и других эндокринных органов, онкологическими или психическими заболеваниями; имеющие алкогольную и наркотическую зависимость, постоянную форму фибрилляции предсердий (ФП), злокачественные новообразования, гемобластозы.
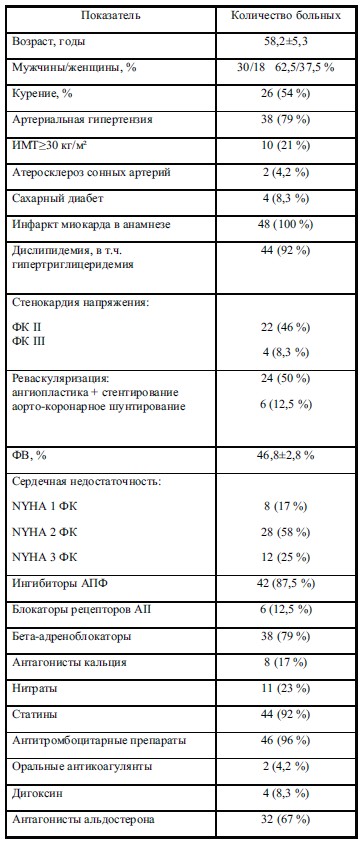
Материал и методы исследования: В исследование были включены 48 больных ИБС, в том числе 30 мужчин и 18 женщин, средний возраст 58,2±5,3 года (М±SD). У всех исследуемых в анамнезе перенесенный инфаркт миокарда различной локализации не ранее 6 месяцев до включения, половине из них выполнено чрезкожное вмешательство (ЧКВ) со стентированием, 6 (12,5 %) пациентам выполнено плановое аортокоронарное шунтирование (АКШ). Стабильная стенокардия II ФК верифицирована у 22, III ФК – у 4 пациентов. 38 (79%) пациентов страдали АГ, у 16 (33 %) больных диагностирован атеросклероз брахиоцефальных артерий, 2 (4,2 %) пациента перенесли каротидную эндартериоэктомию. Кроме того, у исследуемых имелись такие ФР, как курение (у 15 б-х), нарушение липидного обмена у 44 б-х (92 %), в том числе гипер-ТГ у 12 (25 %) б-х. Метаболический синдром выявлен у 10 (21 %) б-х, отягощенный наследственный анамнез у 5, гипертрофия левого желудочка у 32(67 %) б-х. Все пациенты получали стандартную терапию: бета-блокаторы – 38 (79%), АК – 8 (17%), иАПФ –42 (87,5%), сартаны – 6 (12,5%), нитраты – 11 (23 %), аспирин – 46 (96%), антикоагулянты – 2 (4,2%), статины – 44 (92%), дигоксин – 4 (8,3%), спиронолактон – 32 (67%). Средний уровень систолического АД в исследуемой группе составил 128,7±5,4 мм. рт. ст., диастолического АД – 78,1±4,3 мм. рт. ст., средняя ЧСС в покое – 68,2±4,6 уд./мин.
Таблица 1. Клинико- демографическая характеристика пациентов и базовая терапия ИБС (M±m)
В качестве дополнения к базовой терапии назначался Эпадол–Нео производства «Киевский витаминный завод» (Украина) 1 капс. 2 раза в день в течение не менее 3-х месяцев, в наблюдении – до 1 года.
Стандартная 12-канальная ЭКГ выполнялась исходно и через 1 год, Эхо КГ исходно и через 1 год, ХМ ЭКГ исходно, через 3 мес. и 1 год. ХМ ЭКГ проводилось в течение 24 ч с использованием кардиомониторного комплекса «Кардиотехника» (ИНКАРТ-4000, Санкт-Петербург). Запись выполняли в модифицированных биполярных отведениях. Анализ мониторной записи проводили на системе Инкарт-4000.
Лабораторная диагностика: всем больным выполнялись общий анализ крови и мочи, определялись уровни глюкозы в крови и моче, креатинина, показатели общего холестерина (ОХС) и липидного спектра: ЛПНП, ЛПВП, ЛПОНП, ТГ.
Оценка показателей: Учитывались количество госпитализаций по поводу обострения ИБС или декомпенсации ХСН, других сердечно-сосудистых событий. По данным Эхо КГ оценивали ФВ, т.е. динамику систолической функции миокарда на фоне лечения. ЧСС, АД, динамика эктопической активности миокарда оценивались по данным ХМ ЭКГ. Учитывали наличие и вид аритмий; показатели ВРС; количество эпизодов ишемии миокарда, их суммарную длительность; толерантность к физической нагрузке (ТФН) по результатам лестничной пробы. За ишемию миокарда принимали горизонтальную или косонисходящую депрессию сегмента ST на 1 мм и более на расстоянии 0,08 с от точки J продолжительностью более 1 мин. не менее, чем в 2-х отведениях.
По данным суточного ХМ ЭКГ анализировали наджелудочковую и желудочковую эктопическую активность – количество экстрасистол (ЭС) за сутки и степень их тяжести (по классификации Ryan, 1975). При обработке данных количество ЖЭ рассчитывалось за 1 час. За нормальное количество ЭС принимали не более 30 ЭС / час. Количественные изменения после лечения считались достоверными по критериям Bigger: уменьшение числа одиночных ЖЭС минимум на 50 % и более, число ЖЭС высоких градаций (3-4 классов по Ryan) – на 90 %, ЖТ (5 класс) – на 100 %.[6]. Оценивали лабораторные показатели: динамику уровней ОХ, ЛПНП, ЛПВП, ЛПОНП, ТГ.
Для оценки вегетативного тонуса мы использовали стандартные статистические и спектральные методы оценки ВРС. В спектральной области анализировали 2 диапазона: высокочастотный (HF), отражающий уровень парасимпатических влияний на сердечный ритм, и низкочастотный (LF), отражающий преимущественно симпатические влияния [38-39]. Отношение низкочастотного к высокочастотному компонентам (LF/HF) отражает наличие и выраженность дисбаланса вегетативной нервной системы (ВНС). Нормой является LF/HF 1,0- 1,1; смешанный тип – 1,2-1,5; ваготонический – менее 1,0, симпатический – более 1,5. Вычисляли среднесуточные показатели. Оценку значимости различий выполняли с использованием уточненного критерия Стьюдента. Различия считали статистически значимыми при р<0,05.
Результаты. Исходно при анализе данных ХМ ЭКГ у 42 (87,5%) пациентов выявлены сочетанные наджелудочковые и желудочковые НРС. Среди ЖНР встречались ЖЭ всех степеней градаций, причем у 45 % из них – высоких градаций, что ассоциируется с высоким риском ВСС. Политопные ЖЭ – у 40 (83%) больных, парные – у 19 (40%), эпизоды аллоритмии по типу би- и тригемении – у 12(25 %) больных, у 8 – эпизоды неустойчивой ЖТ. Желудочковая эктопическая активность преобладала в активный период, у 8 (17 %) больных эти аритмии наблюдались на фоне безболевой ишемии миокарда (ББИМ). Кроме того, регистрировались НЖЭ в патологическом количестве у 13 (27 %) пациентов, в том числе с интермиттирующей аллоритмией у 4 (8,3 %) из них; у 12 (25%) пациентов встречались короткие эпизоды наджелудочковой тахикардии, в том числе у 5 (10,4 %) -пароксизмы ФП.
Клиническими проявлениями (сердцебиение, головокружение, одышка, слабость, стенокардия) сопровождались пароксизмы ЖТ и ФП, а также эпизоды аллоритмии по типу желудочковой бигемении.
При анализе данных ХМ ЭКГ через 3 месяца на фоне приема Эпадола Нео среднесуточное значение ЧСС снизилось на 4,2% (р>0,05); у трети больных отмечено уменьшение среднего числа ЖЭ в течение суток (достоверно) по сравнению с исходными показателями, у других исследуемых разница не достигла статистической значимости из-за значительного разброса индивидуальных показателей (таблица 3).
Динамика выраженности ЖНР на фоне приема Эпадола Нео характеризовалась тем, что уже через 3 месяца терапии количество ЖЭ 1-го и 2-го классов по Ryan снизилось на 33% (р<0,05), эпизодов аллоритмий – на 50% (р<0,05), при уменьшении эпизодов ЖТ в 2 раза и значительном уменьшении эпизодов политопных и парных ЖЭ – на 40 % (р<0,05).
Анализ изменений количества эпизодов наджелудочковых НРС выявил следующее: после 3-х месячной терапии Эпадолом-Нео количество НЖЭ снизилось на 18,0 % (р<0,05), эпизодов аллоритмии (би- и тригеминии) на 50 % (р<0,05).
Удлинение сроков лечения больных до 1 года привело к усилению антиаритмического эффекта Эпадола Нео на желудочковую (в большей степени), и наджелудочковую ЭС. Количество НЖЭ уменьшилось на 52 % (р<0,05), в том числе количество пароксизмов ФП снизилось на 67 % (р<0,05).
Интересно, что наджелудочковая и желудочковая эктопическая активность менялась в большей степени у пациентов с исходной гипертриглицеридемией.
Продолжение приема препарата в течение 1 года сопровождалось дальнейшим снижением количества ЖНР. В итоге ЖЭ 1-го и 2-го классов по Ryan снизились на 57,5%, 3-го и 4-го классов (парные, политопные ЖЭ) – на 70 %, а пароксизмы ЖТ наблюдались только у 1-го больного, то есть количество их снизилось более, чем на 90 % при р<0,05.
Что касается анализа ишемических изменений, то исходно у 20 б-х (41,7 %) по данным ХМ ЭКГ была выявлена депрессия сегмента ST, у 16 (33,3 %) – инверсия зубца Т, у 2 (4,2 %) – элевация сегмента SТ, у 6 (12,5 %) – элевация и депрессия сегмента SТ. 64 % ишемических эпизодов были бессимптомными: ¾ – дневные (в основном при нагрузке), ¼ – ночные. Длительность эпизодов безболевой ишемии (ББИМ) более 15 минут отмечена у 2 б-х (4,2 %). Через 3 месяца данные практически не изменились. Через 1 год количество и общая длительность эпизодов ишемии хотя и уменьшилось, но недостоверно, при этом удельный вес ББИМ увеличился до 84 %.
Таблица 2. Динамика изменений данных ХМ ЭКГ у больных ИБС до начала терапии Эпадолом-Нео и в сроки 3 и 12 месяцев после лечения (М±SD).
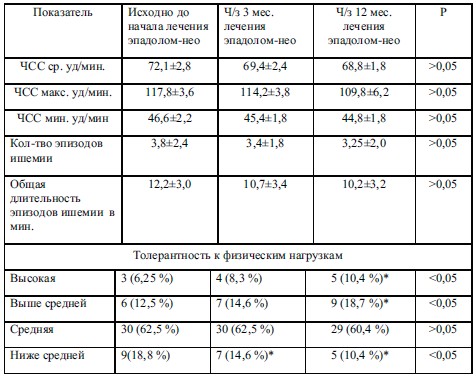
Таблица 3. Влияние Эпадола Нео на экстрасистолическую аритмию и вариабельность ритма сердца у больных с ИБС, постинфарктным кардиосклерозом.
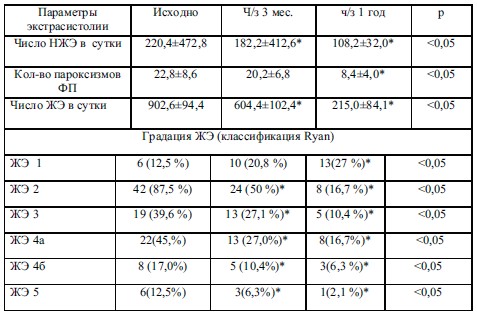
Таблица 4.Динамика суточных показателей ВРС на фоне лечения Эпадолом-Нео больных ИБС с постинфарктным кардиосклерозом.
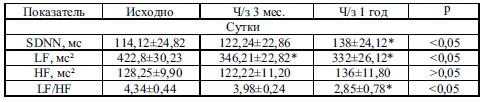
Где, SDNN – квадратный корень из разброса RR-интервалов; HF – мощность в диапазоне высоких частот; LF – мощность в диапазоне низких частот; LF/HF – показатель баланса ВНС.* – достоверность изменений при р<0,05.
Степень вегетативных влияний на сердце проявляется вариабельностью ритма сердца, причем снижение её свидетельствует о преобладании симпатического влияния на миокард (Stein P.K. et al., 1994; Stein P.K., Kleiger R.E., 1999).
В таблице 4 представлена динамика изменений ВРС исходно и в разные сроки на фоне лечения Эпадолом-Нео.
Исходные показатели ВРC были низкими, о чем свидетельствует снижение стандартного отклонения R-R (SDNN) до 114,12±24,82 мс. Это, очевидно, связано с высоким напряжением симпатического отдела ВНС на фоне постинфарктного кардиосклероза. У исследуемых пациентов показатель LF/HF значительно превышал 1,0, что указывало на преобладание симпатической активности над парасимпатической и выраженный вегетативный дисбалас. Особенно это проявлялось у пациентов с метаболическим синдромом и гипер-ТГ. После 3-х месячной терапии Эпадолом-Нео показатели SDNN и LF/HF достоверно не изменились (см. таблицу 4). Одновременно со снижением эктопической желудочковой активности произошло недостоверное снижение индекса напряженности вегетативной регуляции сердечной деятельности, свидетельствующий о снижении симпатического тонуса. Через 1 год наблюдения произошло достоверное увеличение SDNN на 20 % на фоне дальнейшего уменьшения желудочковой эктопической активности и снижение индекса LF/HF с нормализацией его у 38 % пациентов (1,1±0,77), что можно расценивать как положительную реакцию.
Результаты исследования эффективности Эпадола Нео на липидный профиль представлен в таблице 5.
Переносимость Эпадола Нео была хорошей, не было неблагоприятных эффектов, потребовавших его отмены. В 2-х случаях беспокоила отрыжка с привкусом рыбы.
ω-3 ПНЖК, содержащиеся в препарате Эпадол-Нео, относят к повышающим катаболизм и обладающих способностью выводить атерогенные липиды и липопротеиды из сосудистого русла. Несмотря на исходное лечение статинами, на фоне приема Эпадола Нео наблюдалась дополнительная положительная динамика: если через 3 месяца показатели липидного профиля (ОХС, ЛПНП, ЛПВП) не изменились, за исключением ТГ и ЛПОНП (достоверное снижение на 22,3 % и на 10 % соответственно), то через 1 год произошло снижение уровня ОХС на 11,4 % и ЛПНП на 9,1 %, хотя и статистически незначимое, а также достоверное снижение уровня ЛПОНП на 15 % (р<0,05) и ТГ на 34,8 % (р <0,05). Через 1 год у 92 % пациентов уровень ТГ был менее 1,7 ммоль/л. Отмечена тенденция нарастания уровня ЛПВП на 8,9 % (р >0,05).
ФВ по данным ЭхоКГ через год на фоне комбинации стандартной терапии и Эпадола Нео увеличилась недостоверно и в среднем составила 50,2±4,6 %.
Что касается толерантности к физической нагрузке, то исходно по результатам лестничных проб у 39 (81 %) исследуемых она классифицировалась как средняя и ниже средней. На фоне добавления Эпадола Нео через 3 месяца ТФН увеличилась недостоверно, однако через1 год произошло достоверное уменьшение пациентов с низкой ТФН с одновременным увеличением числа пациентов с высокой ТФН при отсутствии изменений числа пациентов со средней ТФН (см. таблицу 2).
Обсуждение. Высокоочищенные ω-3 ПНЖК занимают особую нишу среди других препаратов для вторичной профилактики у постинфарктных больных. Они относятся к списку препаратов, не обладающих непосредственными антиаритмическими свойствами, но при этом они являются единственными препаратами, напрямую влияющими на электрическую нестабильность миокарда [12]. Современные представления о механизме действия омега-3 ПНЖК, приводящем к предотвращению внезапной смерти, хорошо отражены в сообщении: «… ДГК или ЭПК … местно защищают клетки сердца от участия в образовании и распространении желудочковой тахикардии, которая может приводить к остановке сердца и внезапной смерти. Этот защитный эффект … зависит от уникальной способности данного класса омега-З жирных кислот [омега-3-ПНЖК] вызывать стабилизацию электрической активности всех сократительных клеток сердца…» [4,11]. Вкратце, эти препараты действуют на уровне кардиомиоцитов и уменьшают их склонность к развитию аритмии.
В нашем исследовании подтверждено гипотриглицеридемическое действие ω-3 ПНЖК, содержащихся в Эпадоле-Нео, обусловленное уменьшением синтеза ТГ в печени [30]. Снижение уровня ХС ЛНП связано с уменьшением исходного субстрата для их образования [30]. Тенденция к повышению уровня «хорошего» ХС ЛВП на фоне комплексной терапии Эпадола Нео и статинов объясняется механизмом увеличения синтеза ЛВП-подобных фрагментов из частиц ХС ЛОНП, при их ω-3 ПНЖК-опосредованном липопротеидлиполизе, обладающих высокой способностью сорбировать холестерин с клеточных мембран.
В настоящее время убедительно доказана способность ω-3 ПНЖК снижать концентрацию ТГ (33). Механизм этого эффекта по всей видимости связан с активацией рецептора PPAR, что приводит в конечном счете к снижению синтеза ЛПОНП в печени (похожим механизмом обладают фибраты).
По статистике, несмотря на прогресс в лечении ИБС, почти половина больных умирает внезапно, причем в 75-90 % случаев причиной ВСС являются ЖНР [31]. Переход ЖТ в фибрилляцию желудочков впервые зарегистрировал A.Hoffman на ЭКГ в 1912 году [32]. При появлении возможности длительного мониторирования ЭКГ зафиксировано много случаев перехода ЖНР высоких градаций сначала в ЖТ, а затем в финальную ФЖ. Доказано, что наличие ЖНР высоких градаций свидетельствует об электрической нестабильности миокарда [3] и у больных с ИБС ассоциируется с высоким риском ВСС.
Что касается роли гуморальных факторов в патогенезе аритмий сердца, то в литературе накоплено достаточно много информации о влиянии на возникновение и поддержание аритмий неэстерифицированных жирных кислот (НЭЖК), являющихся энергетическим субстратом миокарда и состояния системы перекисного окисления липидов [9].
ω-3 ПНЖК способны не только снижать уровень ТГ и ЛПОНП, но и могут улучшать функцию эндотелия, стабилизировать клеточные мембраны и, что, вероятно, наиболее важно с точки зрения предотвращения возникновения аритмий, способны предотвращать перегрузку кардиомиоцитов кальцием. Помимо этого, антиаритмический эффект, по данным различных авторов, может быть обусловлен модификацией синтеза эйкозаноидов, а также состава жирных кислот (ЖК) фосфолипидов мембран, прямым воздействием неэстерифицированных ЖК на миокард, влиянием ω-3 ПНЖК на инозитный липидный цикл и сигнальную систему клеток и положительным влиянием ω-3 ПНЖК на ферменты и рецепторы.
Учитывая вышесказанное, коррекция нарушений ритма препаратами ω-3 ПНЖК теоретически возможна. Интересные обзоры исследований в этой области были опубликованы Leaf и Kang [13-14]. Наиболее значимые результаты этих исследований можно обобщить так:антиаритмогенное действие высокоочищенных ω-3 ПНЖК свойственно исключительно формам свободных кислот и обусловлено молекулярно-специфическим подавлением трасмембранных ионных каналов. Для других ЖК аналогичные эффекты не были установлены. Наиболее убедительные доказательства такого ингибирующего эффекта были получены в отношении натриевых каналов [15]; тем не менее, калиевые [16] и кальциевые каналы [17] также могут служить мишенями для действия ω-3 ПНЖК. Последние работы указывают на возможность предупреждения фатальных аритмий при употреблении ω-3 ПНЖК за счет торможения быстрых натриевых каналов и кальциевых каналов L-типа (37). Более того, ДГК ингибирует калиевые каналы задержанного выпрямления, которые отвечают за фазу деполяризации желудочкового и предсердного потенциалов.
Первичный эффект ω-3 ПНЖК на трансмембранные каналы заключается в удлинении неактивной стадии. При воздействии ω-3 ПНЖК в кардиомиоцитах повышаются пороговые уровни деполяризации. Leaf и сотр. [14, 15] предположили, что этот эффект связан с размещением молекул ω-3 ПНЖК на особо значимых участках, непосредственно примыкающих к ионным каналам, т.е. микроокружение ионных каналов изменяется при включении ω-3 ПНЖК в мембраны, а для достижения электрической стабилизации в сарколемме требуется поддержание низкомолярного (<0,01) соотношения ω-3 ПНЖК к фосфолипидам [24].
Полученные результаты в GISSI-Prevenzione подтверждаются результатами других клинических исследований. В частности, наблюдения в исследовании DART (Diet and Reinfarction)[25] послужили основанием для подтверждения влияния препарата на конечные точки, установленные в GISSI-Prevenzione.
Исследование DART – клиническое исследование, проведенное у 2033 больных без диабета в возрасте моложе 70 лет, которые находились в восстановительном периоде после перенесенного недавно инфаркта миокарда [25]. Выраженность терапевтического эффекта, наблюдавшаяся в DART (снижение смертности от всех причин на 29%), была сопоставима с результатами GISSI-Prevenzione (снижение смертности от всех причин на 20%) и сочеталась с проявлением раннего влияния омега-3 ПНЖК в виде уменьшения ВСС [25].
Сообщения из обсервационных исследований также подтверждают заключение о том, что омега-3-ПНЖК предотвращают ВСС [26-27].
В сердечно-сосудистом континууме активация симпатической нервной системы (СНС) играет основную роль на этапе развития и прогрессирования ХСН, что сопровождается повышением циркуляции катехоламинов в крови. Наряду с рубцовыми и ишемическими изменениями миокарда у постинфарктных больных, повышенная активность СНС является предиктором нарушений ритма сердца, в частности, ЖЭ [8]. Несколько РКИ показали, что ω-3 ПНЖК могут восстанавливать симпатовагальный баланс (34-36).
При анализе данных ХМ ЭКГ для оценки вегетативного тонуса на основании расчета показателей ВРС мы использовали показатель SDNN, частотные показатели спектра LF и HF и индексLF/HF. Была выявлена сниженная ВРС, повышение тонуса СНС по показателям частотного анализа спектра, что наряду с ишемией и структурными изменениями, обусловленными фиброзом и постинфарктным ремоделированием миокарда объясняют «готовность» миокарда к аритмогенезу.
Низкая или сниженная ВРC сочетается с неблагоприятным прогнозом и повышенным риском ВСС [18,19,20]. Результаты обсервационных исследований свидетельствуют о благоприятном эффекте ω-3 ПНЖК у больных, перенесших инфаркт миокарда – в виде повышения ВРС [21,22]. Возможно, в перспективе, именно измерение отклонений ВРC будет иметь практическое значение для динамического контроля реакции на терапию ω-3 ПНЖК, учитывая отсутствие доступных адекватных методов оценки содержания ω-3 ПНЖК в клеточных мембранах.
Экспериментальные данные свидетельствуют о том, что увеличение желудочков сердца сопровождается активацией ионных каналов и появлением неравномерной длительности потенциала действия (ПД), что может рассматриваться, как предрасполагающий фактор к развитию аритмии даже при отсутствии выявляемой ишемии миокарда. Результаты исследования GISSI-Prevenzione свидетельствуют о том, что высокоочищенные ω-3 ПНЖК являются важным и неотъемлемым компонентом в лекарственной терапии больных, перенесших инфаркт миокарда [23]. Благоприятные терапевтические эффекты, которые заключаются в снижении смертности от всех причин, достаточно хорошо выражены и обусловлены в значительной степени снижением риска ВСС, в отношении которого была показана устойчивость к другим формам лекарственного вмешательства. Более того, режим лечения Эпадолом-Нео достаточно простой – 2 капсулы препарата (2 г) в сутки, что обусловливает крайне низкую частоту и тяжесть побочных эффектов. Соотношение благоприятных эффектов и риска такого лечения в дополнение к доступной цене, свидетельствует в пользу широкого применения данного препарата у больных, перенесших инфаркт миокарда.
Выводы:
- При длительном (не менее 1 года) приеме ω-3 ПНЖК в виде Эпадола Нео в суточной дозе 2 г обладают выраженной антиаритмической эффективностью при частой ЖЭ, наличии ЖЭ высоких градаций у пациентов с постинфарктным кардиосклерозом и стабильнй ИБС, находящихся на базовой терапии.
- Эпадол-Нео обладает не только способностью уменьшать желудочковую эктопическую активность, но при длительном приеме эффективен при наджелудочковых аритмиях: пароксизмах фибрилляции предсердий и частой наджелудочковой экстрасистолии, в том числе при аллоритмиях.
- Эпадола Нео влияет на показатели ВРС: снижает индекс напряженности вегетативной регуляции сердечной деятельности, уменьшает симпатическую активность, повышает ВРС, что коррелирует с эктопической активностью миокарда.
- Благодаря антиаритмической эффективности и способности влиять на ВРС, нормализуя вегетативный дисбаланс, Эпадол-Нео может использоваться во вторичной профилактике фатальных аритмий и внезапной сердечной смерти у постинфарктных пациентов.
- Эпадол-Нео способен в дополнение к статинам обеспечить достижение целевого уровня триглицеридов у пациентов с гипертриглицеридемией.
- Таким образом, эпадол-нео в дозе 2г/сутки целесообразно рекомендовать больным ИБС с постинфарктным кардиосклерозом и дислипидемией (особенно – гипертриглицеридемией), страдающими желудочковыми нарушениями ритма высоких градаций, для длительного применения с целью профилактики внезапной сердечной смерти.
Литература:
- William Harris. The Omega-3 Index – a new cardiovascular risk marker. The Omega-3 Centre’s 2007 Annual Symposium. A focus on long chain omega-3.
- Нифонтов Е.М., Шихалиев Д.Р., Красичков А.С., Богачев М.И., Шляхто Е.В.Антиаритмическая эффективность омега-3 полиненасыщенных жирных кислот у больных стабильной ишемической болезнью сердца с желудочковыми нарушениями ритма
- Дощицын В.Л. Внезапная аритмическая смерть и угрожающие аритмии. //Российский кардиологический журнал, 1999, №1, с.45-51.
- Rosenberg IH. Fish – Food to calm the heart. N Engl J Mod 2002; 346: 1102-3.
- BiggerJ.T. Current approaches to drug treatment of ventricular arrhythmias//Amer.J.Cardiol.1987. Vol. 60, p.10f-20f.
- BiggerJ.T., Weld E.M. Analysis of prognostic significance of ventricular arrhythmias after myocardial infarction: shortcomings of Lown grading system //Brit. Heart J. 1981 Vol.45, №6, p.717-724.
- Lown B. Sudden cardiac death: the major challenge confronting contemporary cardiology// Am.J.Cardiol. 1979 Vol.43, №2, p. 313-328.
- Pagani M., Lombardi F.,Guzzetti S. et al. Power spectral analysis of heart rate and arterial pressure variabilities as a marker of sympathovagal ineraction in man and conscious dog. Circ Res 1986;59:178-193.;9,10.
- Вахляев В.Д., Недоступ А.В., Царегородцев Д.А., Мазинг М.Ю. Роль гуморальных факторов в патогенезе аритмий сердца.// Российский медицинский журнал 2000; 2:54-7;4:47-50.
- Eckardt L., Haverkamp W., Johna R. et al. Arrhythmias in heart failure: current concepts of mechanisms and therapy.//J Cardiovascular Electrophysiol 2000 Jan;11(1):106-17.
- Priori SG, Allot E, Blomstrom-Lundqvist C, Bossaert L, Breithardt G, Brugada P, Camm AJ, Cappato R, Cobbe SM, Di Mario C, Maron BJ, McKenna WJ, Pedersen AK, Ravens U, Schwartz PJ, Trusz-Gluza M, Vardas P, Wellens HJJ, Zipes DP. Task Force on Sudden Cardiac Death of the European Society of Cardiology. Eur Heart J 2001; 22: 1374-450.
- Rupp H. (1), Verboom C.-N. (2) , Jager B. (2) Journal of Clinical and Basic Cardiology” (2002; 5: 209-214)
- Leaf A, Kang JX. Prevention of cardiac sudden death by n-3 PUFAs: a review of the evidence. J Int Med 1996: 240: 5-12.
- Kang JX, Leaf A. Antiarrhythmic effects of polyunsaturated fatty acids. Circulation 1996; 94:1774-80.
- Kang JX, Leaf A. Evidence that free polyunsaturated fatty acids modify Na+ channels by directly binding to the channel proteins. Proc Natl Acad Sci USA 1996:93:3542-6.
- Honore E, Barhanin J, Attali B, Lease F, Lazdunski M. External blockade of the major cardiac delayed-rectifier K+ channel (Kvl.5) by polyunsaturated fatty acids. Proc Natl Acad Sci USA 1994; 91: 1937-44.
- Hallaq H, Smith TW, Leaf A. Modulation of dihydropyridine-sensitive calcium channels in heart cells by fish oil fatty acids. Proc Natl Acad Sci USA 1992: 89: 1760-4.
- Bigger JT, Fleiss JL. Rolnitzky LM, Steinman RC. Frequency domain measures of heart period variability to assess risk late after myocardial infarction. J Am Coll Cardiol 1993; 21: 729-36.
- Kleiger RE, Miller JP, Bigger JT, Moss AJ, and the Multicenter Post-Infarction Research Group. Decreased heart rate variability and us association with increased mortality after acute myocardial infarction. Am J Cardiol 1987: 59: 256-62.
- Stein PK, Kleiger RE. Insights from the study of heart rate variability. Annu Rev Med 1999:50:249-61.
- Christensen JH, Korup E, Aaroe J, Toft E, Mailer J. Rasmussen K, Dyerberg J, Schmidt EB. Fish consumption, n-3 PUFAs in cell membranes, and heart rate variability in survivors of myocardial infarction with left ventricular dysfunction. Am J Cardiol 1997; 79: 1670-3.
- Christensen JH, Christensen MS, Dyerberg J, Schmidt EB. Heart rate variability and fatty acid content of blood cell membranes: a dose-response study with n-3 PUFAs. Am J Clin Nutr 1999; 70: 331-7.
- GISSI-Prevenzione Investigators. Dietary supplementation with n-3 polyunsatu-rated fatty acids and vitamin E after myocardial infraction: results of the GISSI-Prevenzione trial. Lancet 1999; 354: 447-55.
- Pound EM, Kang JX, Leaf A. Partitioning of polyunsaturated fatty acids, which prevent cardiac arrhythmias, into phospholipid cell membranes. J Lipid Res 2001:42:346-51.
- Burr ML, Fishily AM, Gilbert JF, Rogers S, Holliday RM, Sweetnam PM, Elwood PC, Deadman NM. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet 1989:8666:757-61.
- Hu FB, Bronner L, Willett WC, Stampfer MJ, Rexrode KM, Albert CM. Hunter D. Manson JE. Fish and omega-3 fatty acid intake and risk of coronary heart disease in women JAMA 2002: 287: 1815-21.
- Albert CM, Campos H, Stampfer MJ. Rider PM, Manson JE, Willett WC, Ma J. Blood levels of long-chain n-3 PUFAs and the risk of sudden death. N Engl J Med 2002; 346: 1113-8.
- Marchioli R, Barzi F, Bomba E, Chieffo C, Di Gregorio D, Di Mascio R, Franzosi MG, Geraci E, Levantesi G, Maggioni AP, Mantini L, Marfisi RM. Mastrogiuseppe G, Mininni N, Nicolosi GL, Santini M, Schweiger C, Tavazzi L, Tognoni G, Tucci С Valagussa F. on behalf of the GISSI-Prevenzione investigators. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction. Circulation 2002: 105: 1897-903.
- Marchioli R. Treatment with n-3 polyunsaturated fatty acids after myocardial infarction: results of GISSI-Prevenzione Trial. Eur Heart J Suppl 2001; 3 (Suppl D): D85-D97.
- Leaf A, Weber PC. Cardiovascular effects of n-3 fatty acids // N Engl J Med. – 1988. – Vol. 318 (9). – P. 549-557.
- Lopera G., Huikuri H.V., Makikallio T.h. et al. Ischemic sudden deaph: critical analysis of risk markers. Part VIII.//Rev Esp Cardiol, 2000 Apr;53(4):568-74.
- Кушаковский М.С. Аритмии сердца.// «Фолиант», С.-Петербург, 1998, стр. 206.
- von Schacky C, Harris WS. Cardiovascular benefits of omega-3 fatty acids. Cardiovasc Res 2007;73:310 –5.
- Christensen JH, Gustenhoff P, Korup E, et al. Effect of fish oil on heart rate viability in survivors of myocardial infarction: a double blind randomized controlled trial. Br Med J 1996;312:677– 8.
- O’Keefe JH Jr., Abuissa H, Sastre A, Steinhaus DM, Harris WS. Effects of omega-3 fatty acids on resting heart rate, heart rate recovery after exercise, and heart rate viability in men with healed myocardial infarctions and depressed ejection fractions. Am J Cardiol 2006;97: 1127–30.
- Geelen A, Brouwer IA, Schouten EG, Maan AC, Katan MB, Zock PI. Effects of n-3 fatty acids from fish on premature ventricular complexes and heart rate in humans. Am J Clin Nutr 2005;81:416 –20.
- Anand RG, Alkadri M, Lavie CJ, Milani RV. The role of fish oil in arrhythmia prevention. J Cardiopulm Rehabil 2008;28:92–8.
- Malik M., Camm A. Components heart rate variability: what they really mean and what we really measure Am J Cardiol 1993; 72:821- 822.
- Pomeranz M., Macaulay R.J.B., Caudill M.A. et al. Assessment of autonomic function in humans by heart rate spectral analysis. Am J Phisyol 1985; 248:H151 H153.
Стаття надана мовою оригіналу





