
 Article
Article
 25.02.2025
25.02.2025
Преимущества применения ИРБЕТАНА(ирбесартана) при сахарном диабете 2 типа и кардиальной автономной нейропатии сердца..
Доцент, к.мед.н., кафедра диабетологии НМАПО имени П.Л. Шупика Жердева Н.Н.
Ключевые слова: сартаны, сахарный диабет (СД), кардиальная автономная нейропатия сердца (КАН), диабетическая нефропатия, диабетическая нейропатия, болезнь Альцгеймера.
Диабетическая нейропатия (ДН) в зависимости от вовлечения в процесс спинно-мозговых нервов и/или вегетативной нервной системы делится на периферическую, центральную и автономную нейропатию. Клиническая картина автономной нейропатии (АН) вариабельна. Среди нейропатических осложнений наибольшую клиническую, диагностическую значимость играют кардиососудистые осложнения. К моменту постановки диагноза у одной четверти больных СД 2 типа уже выявляются клинические проявления ДН, что объясняется длительной доклинической фазой[1,2].
Повышение активности симпатического отдела нервной системы, вызванное парасимпатической дисфункцией, считается важным фактором развития артериальной гипертензии (АГ), особенно на ранних стадиях формирования АГ при развитии гиперкинетического типа кровообращения. Сопровождающая артериальную гипертензию тахикардия обычно является результатом нарушения автономной регуляции сердца и расценивается некоторыми авторами как признак развития «фиксированной» гипертензии [3]. По данным суточного мониторирования АД, подтверждено наличие АГ у значительной части больных с кардиоваскулярной АН, а степень тяжести последней коррелирует с уровнем повышения САД и ДАД. В исследовании EURODIAB выявлена значительная степень корреляции между автономной дисфункцией и подъемом ДАД [4]. Результаты последних лет также продемонстрировали роль АНС в формировании суточного ритма колебания уровня АД. Ночные значения АД обычно более низки, чем дневные, как у больных АГ, так и у здоровых людей. Отсутствие снижения АД в ночное время является клинически значимым нарушением, так как оно ассоциируется с более тяжелым поражением органов-мишеней, главным образом с развитием левожелудочковой гипертрофии, и повышает риск развития сердечно-сосудистых осложнений. Повышение САД ночью на 10 мм рт. ст. ассоциировано с возрастанием кардиоваскулярного риска на 31%. Причиной отсутствия снижения АД в ночное время считается дисбаланс симпатической и парасимпатической активности, состоящий в относительном преобладании ночью симпатической иннервации. [3].
При этом тахикардия покоя часто выступает в качестве первого раннего признака развивающейся АН и поэтому имеет высокую диагностическую ценность. Блуждающий нерв является наиболее длинным из всех нервов, иннервирующих сердце, а при АН он поражается в первую очередь, что приводит к преобладанию симпатических влияний и развитию тахикардии покоя. Тахикардия уменьшается по мере последующего развития автономной симпатической нейропатии, при этом ЧСС остается достаточно высокой. Отсутствие увеличения ЧСС при перемене положения тела препятствует компенсаторному увеличению сердечного выброса, что усиливает проявления ортостатической гипотензии. Одно из самых значительных связующих звеньев между кардиоваскулярной АН и внезапной кардиогенной смертью было выявлено после того, как удалось продемонстрировать существование нейропатического удлинения интервала Q–T, который коррелирует с изменениями результатов тестирования симпатических и парасимпатических функций. Подбор антиаритмической терапии у больных с кардиоваскулярной АН имеет свои особенности. Например, у пациентов с поражением парасимпатической нервной системы следует ожидать снижения антиаритмического действия дигиталиса, обусловленного влиянием препарата на афферентные и эфферентные волокна вагуса; при поражении симпатической нервной системы уменьшается эффективность b-блокаторов: они теряют антиангинальные свойства и способность снижать ЧСС. Необходимо также учитывать проаритмогенные свойства отдельных препаратов. Амиодарон, например, удлиняет интервал Q–T, но уменьшает его дисперсию; антиаритмические препараты IA и IC класса часто одновременно влияют на увеличение и продолжительности, и дисперсии интервала Q–T. Еще одним из проявлений АН является безболевая ишемия миокарда, которая является следствием поражения симпатических афферентных волокон. У пациентов с СД и АН данное осложнение встречается до 92,0% случаев. Кроме того, при суточном мониторировании ЭКГ БИМ диагностируется в 64,7% случаев у больных СД, страдающих нейропатией. Основной причиной смерти больных диабетом является инфаркт миокарда, протекающий бессимптомно или с атипичными болями у 32–42% больных, в то время как частота атипичных инфарктов у пациентов, не страдающих СД, составляет лишь 6–15%. Прогноз особенно неблагоприятен с учетом того, что фатальные последствия имеют 47% безболевых инфарктов и лишь 35% болевых инфарктов [5-8].
Ранняя диагностика бессимптомных инфарктов и снижение уровня связанной с ними смертности возможны лишь при своевременном обращении пациентов с сахарным диабетом к врачу, адекватной гипотензивной терапии с учетом влияния различных групп препаратов на симпатическую и парасимпатическую нервную системы.
На сегодняшний день результатами многочисленных исследований, таких как ALLHAT, IDNT, IRMA II, EUROPA, FACET, HOPE, NORDIL, RENAAL, STOP-Hypertension-2, INSIGHT, UKPDS и др., доказано, что ингибиторы ангиотензинпревращающего фермента (ИАПФ) и ингибиторы рецепторов ангиотензина II (ИАРА – сартаны), одинаково эффективны при артериальной гипертензии (АГ), коронарном и каротидном синдромах, гипертрофии миокарда левого желудочка, хронической сердечной недостаточности (ХСН), фибрилляции предсердий (ФП) и при многих других сердечно-сосудистых и связанных с ними, как, например, сахарный диабет (СД) заболеваниях, что способствует повышению качества жизни, снижению заболеваемости и смертности в соответствующих популяциях больных. Причем в стратегиях, направленных на решение этих задач, в последние годы все большее значение приобретают сартаны[9-14].
В развитии сердечно-сосудистых и связанных с ними заболеваний и синдромов наряду с симпатическим дистрессом исключительное место принадлежит активированию ренин-ангиотензин-альдостерон-адреналовой системы (РААС). Компоненты РААС расположены в организме повсюду: в надпочечниках, миокарде, сосудах, веществе мозга и т.д. Здесь же находятся их рецепторы. Поэтому, если происходят нарушения в РАСС, они проявляются повсеместно. Конечными продуктами активации РААС являются ангиотензин I (АТ) и альдостерон (АН). АТ активирует симпатическое звено нервной системы, стимулирует освобождение нейрогормонов, АН и других биологически важных структур. При хроническом перенапряжении РААС развивается стойкая вазоконстрикция, возрастает артериальное давление (АД) и частота сердечных сокращений (ЧСС), появляются жизнеопасные аритмии, развивается и прогрессирует ХСН. Компоненты РААС прямо влияют на функции эндотелия и оказывают действие на многие структуры мозга, такие как паутинная оболочка, гипоталамические паравентрикулярные ядра, ядра автономной нервной системы и др. Если с активацией АТ индуцируются синтез и освобождение АН на системном и местном уровнях, то АН, со своей стороны, активирует стресс-опосредованные реакции АТ. В итоге АТ и АН выступают как самоподдерживающаяся система, роковая для сердечно-сосудистых заболеваний и синдромов. При присоединении почечных нарушений девиации регуляции усиливаются, из-за чего сердечно-сосудистая система страдает еще больше, раскручивая порочный круг. Ядром функционирования влияний РААС является ангиотензин II, реализующий свои эффекты через стимуляцию специфических рецепторов. Впервые способность сартанов улучшать отдаленный прогноз у пациентов с АГ была показана в исследовании LIFE, в котором при сопоставлении клинической эффективности сартана и атенолола, было показано, что при одинаковом снижении артериального давления (АД) в обеих группах пациентов скорость обратного развития гипертрофии левого желудочка (ЛЖ) при лечении сартаном оказалась достоверно более высокой, было найдено также достоверно большее снижение частоты сердечно-сосудистой смерти, развития нефатального инфаркта миокарда или инсульта и, дополнительно, достоверное снижение частоты развития новых случаев сахарного диабета (СД). Лечение сартаном способствовало также снижению риска развития инсульта на 25%. Результаты этого исследования позволили U.S. Food and Drug Administration/FDA зарегистрировать новые показания для клинического использования сартана: первичная профилактика цереброваскулярных катастроф при АГ с гипертрофией ЛЖ и был рекомендован также для лечения пациентов с диабетической нефропатией с повышением плазменного уровня креатинина и протеинурией [9,10,12,13]. Клинические исследования IDNT, ABCD-2V, CALM, RENAAL, VALUE и др. подтвердили высокую эффективность сартанов при сердечно-сосудистых заболеваниях с диабетической нефропатией[12,13]. Как уже говорилось ранее одним из важнейших моментов при лечении АГ является профилактика цереброваскулярных осложнений. Данный положительный эффект препаратов этой группы может быть связан с несколькими механизмами:
- прямой нейропротекцией, опосредованной действием АТ II через AT2-рецепторы.
- блокирование симпатической вазоконстрикции с системной вазодилатацией и снижением общего периферического сосудистого сопротивления без увеличения частоты сердечных сокращений;
- антипролиферативное и органопротективное действие;
- обратное развитие гипертрофии миокарда и гладких мышц сосудов;
- улучшение эндотелиальной функции сосудов;
- органопротективное (в том числе ренопротективное) действие.
Ретроспективное исследование пяти миллионов пациентов, которое проводилось в соответствии с записями (документации) департамента США по делам ветеранов (Department of Veterans Affairs) показало, что использование различных типов антигипертензивных препаратов, которые широко используются в современной практике, по разному влияет на развитие болезни Альцгеймера (БА). У пациентов, которые принимали блокаторы рецепторов ангиотензина (БРА) риск развития БА был ниже на 35-40% по сравнению с теми людьми, которые использовали другие гипотензивные средства[14-18]. Среди прочего, сартаны обладают регуляторным влиянием на углеводный и жировой обмен. У пациентов с сахарным диабетом 2-го типа на фоне приема сартанов отмечается уменьшение инсулинорезистентности за счет стимуляции ядерных PPAR-рецепторов клеток жировой и мышечной тканей, а также гепатоцитов. Доказано, что у пациентов, получающих сартаны в качестве антигипертензивного средства или в комплексной терапии хронической сердечной недостаточности, уменьшается частота новых случаев сахарного диабета 2-го типа (исследования LIFE, VALUE, CHARM, SCOPE). Со стимуляцией PPAR-рецепторов связаны также гиполипидемические эффекты сартанов. Доказано, что у пациентов с дислипидемией, сартаны, назначенные дополнительно к статинам, снижают риск кардиоваскулярных событий почти вдвое[19,20].
Целью нашего исследования было определить эффективность применения ирбетана в лечении артериальной гипертензии у пациентов с сахарным диабетом 2 типа провлениями автономной нейропатии.
Материал и методы
Обследовано 30 пациентов с СД 2-го типа с наличием не леченной артериальной гипертензии. Пациенты получали препарат ИРБЕТАН в начальной дозе 150 мг в сутки с последующей коррекцией дозы препарата до 300 мг в сутки, для достижения целевых уровней артериальной гипертензии. Длительность лечения составила 8 недель. Препараты применяли на фоне стабильной сахароснижающей терапии.
Был собран анамнез жизни, заболевания, определены антропометрические показатели. Пациентам были проведены измерения САД, ДАД, пульса до и после лечения. Также определяли до начала исследования и через 8 недель после приема препарата ИРБЕТАН уровень общего ХС, триглицеридов, сахара крови натощак, НbA1c.
Всем пациентам, до и после лечения, были проведено исследование кардиоваскулярных рефлексов (5 стандартных тестов по Ewing) включающих изменение ЧСС при медленном глубоком дыхании (6 в 1 мин), тест Вальсальвы, тест Шелонга (ортостатическая проба), тест 30:15, пробу с изометрической нагрузкой.
Статистическую обработку полученных результатов осуществляли с помощью стандартного пакета анализа данных «Microsoft Excel» на персональном компьютере. Вероятность различий показателей оценивали с применением теста Стьюдента для парных величин. Различия считали достоверными при P<0,05.
Результаты и их обсуждение
В исследование были включены 30 пациентов с сахарным диабетом 2 типа, из них 6 пациентов мужского и 24 – женского пола. Средний возраст составлял 61,4±0,84 года, индекс массы тела 31,81±0,66 кг/м2. Длительность заболевания сахарным диабетом составила 8,56±0,89 лет. На инсулинотерапии находилось 5 пациентов, 25 – на пероральных сахароснижающих препаратах.
Динамика исследуемых показателей под влиянием лечения у пациентов, включенных в исследование, приведена в таблице.
Таблица 1. Динамика антропометрических и биохимических исследуемых показателей у пациентов с СД 2-го типа под влиянием лечения ИРБЕТАНом
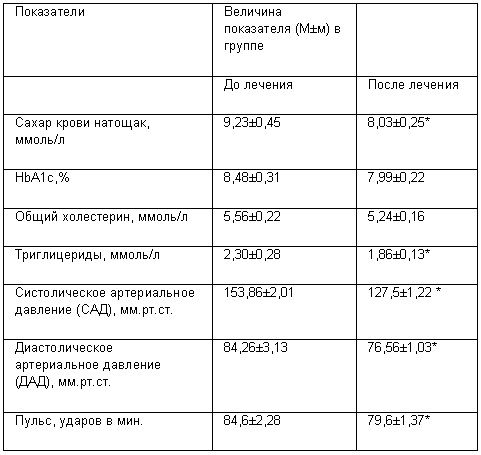
Примечание. * – различия показателей достоверны по сравнению с таковыми до лечения (P<0,05).
Как видно из таблицы 1 отмечается достоверно значимая нормализация уровней, как САД, так и ДАД. Также отмечается достоверное снижение уровня ТГ и тенденция к нормализации уровня ОХ. Это связано со стимуляцией ИРБЕТАНом PPAR-рецепторов, что в свою очередь привело к гиполипидемическому действию. Так же действием на эти рецепторы можно объяснить достоверно значимое снижение уровня гликемии натощак, путем снижения инсулинорезистентности. Таким образом, мы можем говорить о положительном гиполипидемическом и метаболическом действии препарата, что в свою очередь подтверждает данные исследования LIFE, и позволяет, широко использовать данную группу препаратов, не боясь возникновения новых случаев СД 2 типа или декомпенсации диабета.
Таблица 2. Динамика показателей кардиоваскулярных тестов у пациентов с СД 2-го типа под влиянием лечения ИРБЕТАНом

Как видно из табл. 2 у пациентов с сахарным диабетом при проведении измерения ЧСС при медленном глубоком дыхании (6 в одну минуту), наблюдаемое в норме ускорение ЧСС на вдохе и урежение на выдохе исчезает по мере прогрессирования недостаточности парасимпатической иннервации сердца, что наблюдалось у 18 из 30 пациентов до лечения. Разница между минимальной и максимальной ЧСС в 10 ударов и менее свидетельствует о нарушении парасимпатической иннервации сердца (N >15). У 11 пациентов были обнаружены патологические значения при проведении теста Вальсальвы, который нам также говорит о поражении парасимпатической иннервации и наличии кардиальной нейропатии сердца. Патологическим считается если отношение величины максимального RR интервала в первые 20 с. после пробы к минимальному интервалу R-R во время пробы менее 1,3. При повышении внутрилегочного давления в норме ЧСС увеличивается с последующей компенсаторной брадикардией. При нарушении парасимпатической регуляции сердечной деятельности этот феномен выпадает. Проведение Теста Шелонга (ортостатической пробы), который говорит нам о поражении симпатической нервной системы, когда разница между АД в положении лежа и стоя составляет более 30 мм.рт.ст., не показал патологических отклонений до лечения у наших пациентов. У 5 пациентов были определены пограничные значения и у 25 нормальные. Но по данным теста 30:15. основаный на учащении ЧСС при вставании с максимальным значением к 15 удару с последующим урежением ритма с минимальным значением к 30 удару у 22 пациентов до лечения было обнаружено патологическое значение. Отношение 15-го R-R интервала к 30-му с момента начала вставания при ортопробе ниже 1,2 является диагностическим критерием КАН (N >1,35). У 9 больных также было определено поражение симпатической иннервации при проведении пробы с изометрической нагрузкой. При сжатии динамометра в течение 3 мин до 1/3 максимальной силы руки отмечается подъем ДАД. Повышение ДАД менее чем на 10 мм рт. ст. говорит о КАН (кардиальной автономной нейропатии) с недостаточной симпатической иннервацией (N >15 мм рт. ст.).
Таким образом, проведя анализ кардиоваскулярных проб мы можем утверждать, что у пациентов с сахарным диабетом происходит поражение как симпатической, так и парасимпатической регуляции сердечной деятельности. Но отдельно проведенные тесты не могут нам говорить о наличии КАН. При общей оценке всех результатов у 15 пациентов из 30 было диагностировано КАН до начала лечения, т.е. сумма по всем тестам была выше 6 баллов.
После проведенного курса лечения препаратом ИРБЕТАН в дозе 300 мг, на фоне нормализации АД, отмечалось снижение проявления КАН (кардиальной автономной нейропатии). Так патологические значения были выявлены у 7 пациентов при проведении измерения ЧСС при медленном глубоком дыхании; у 4 пациентов – при проведении пробы Вальсальвы; у 7 пациентов – на пробе 30:15. Таким образом, после проведенного лечения, было определено КАН у 3 пациентов.
Не было зарегистрировано побочных действий на фоне приема изучаемого препарата.
В заключение можно сказать, что данный препарат помимо доказанного гипотензивного и ренопротекторного действия, обладает гиполипидемическим действием, уменьшая уровень триглицеридов на 19,14% и положительным метаболическим действием за счет снижения инсулинорезистентности, путем влияния на PPAR-рецепторы. Достоверно уменьшает проявления диабетической нейропатиии, а именно кардиальной автономной нейропатии сердца, и снижения риска развития сердечно – сосудистых заболеваний у больных сахарным диабетом.
Литература.
- Report and Recommendationis of the San Antonio Conference on Diabetic Neuropathy//Diabetes.-1988/-№-1000.
- Котов С.В. и соавт., Диабетическая нейропатия, М., 2000, 39 стр.
- Ziegler D. Diabetic cardiovascular autonomic neuropathy: Prognosis, diagnosis and treatment. Diabetes Metab Rev 1994;10:339-83.
- Fuller JH and the EURODIAB 1DDM Study Group. Blood pressure response to standing in the diagnosis of autonomic neuropathy: the EURODIAB IDDM Complications Study. Arch Physiol Biochem 2001;109:215-22.
- Jermendy G. The effectiveness of Milgamma in treatment of diabetic polyneuropathy. Medicuc Universalis 1995; 217–220. 15.
- Monteagudo PT, Moises VA, Kohlman OJ, Ribeiro AB, Lima VC, Zanella MT. Influence of autonomic neuropathy upon left ventricular dysfunction in insulin-dependent diabetic patients. Clin Cardiol 2000; 23:371-5.
- Rtossing P, Breum L, Major-Peder sen A, Sato A, Winding H et al. Prolonged QTc interval predicts mortality in patients with type 1 diabetes mellitus. Dibetic Med 2001;18:199-205.
- Willenheimer RB, Erhardt LR. Nilsson H, Lilja B, Juul-Moller S, Sundkvist G. Parasympathetic neuropathy associated with left ventricular diastolic dysfunction in patients with insulin-dependent diabetes mellitus. Scand Cardiovasc -J 1998;32:17-22.
- 2003 European Society of Hypertension–European Society of Cardiology guidelines for the management of arterial hypertension. Guidelines Committee. Journal of Hypertension 2003, 21:1011–1053
- Dahlof B., Devereux R.B., Kjeldsen S., et al, for the LIFE Study group. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. Lancet. 2002; 359:995–1003
- Lithell H., Hansson L., Skoog I., et al. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial. J Hypertens. 2003; 21:875–886
- Viberti G., Wheeldon N.M. Microalbuminuria reduction with valsartan in patients with type 2 diabetes mellitus: a blood pressure-independent effect. Circulation 2002; 106:672–78
- Palmer, AJ and Annemans, L and Roze, S and Lamotte, M and Rodby, RA and Bilous, RW, An economic evaluation of the Irbesartan in Diabetic Nephropathy Trial (IDNT) in a UK setting, Journal of Human Hypertension, 18, (10) pp. 733-738. ISSN 0950-9240 (2004)
- Kehoe PG, Wilcock GK. Is inhibition of the renin–angiotensin system a new treatment option for Alzheimer’s disease? Lancet Neurol 2007; 6: 373–8 [CrossRef] [Medline].
- Launer LJ, Petrovitch H, Ross GW et al. AD brain pathology: vascular origins? Results from the HAAS autopsy study. Neurobiol 2008: 1587– 90 [CrossRef] [Medline].
- Duron E, Rigaud A-S, Lenoir H et al. Effects of antihypertensive therapy on cognitive decline in Alzheimer’s disease. J Hypertens 2008; 26: S474. Abstract PS33/THU/37.
- Li NC, Lee A, Whitmer RA et al. Use of angiotensin receptor blockers and risk of dementia in a predominantly male population: prospective cohort analysis. BMJ340, B5465 2010. [CrossRef] [Medline].
- Davies NM et al Associations of Anti-Hypertensive Treatments with Alzheimer’s Disease, Vascular Dementia, and Other Dementhias. J Alzheimers Dis 2011; 26: 699–708.
- Top C., Cingozbay B.Y., Terekeci H. et al. The effects of valsartan on insulin sensitivity in patients with primary hypertension. J Int Med Res 2002; 30:15–20
- Elliott W.J., Meyer P.M. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis. 2007; 369:201–207
Стаття надана мовою оригіналу





