
 Article
Article
 03.02.2025
03.02.2025
Оптимізація гіполіпідемічної терапії у хворих високого кардіометаболічного ризику.
Мітченко О.І., Романов В.Ю ДУ ННЦ «Інститут кардіології ім. акад. М.Д.Стражеска» НАМН України Відділ дисліпідемій
В даний час хвороби системи кровообігу займають перше місце в структурі смертності населення України. Добре вивченими є основні фактори ризику розвитку серцево-судинних захворювань, до яких відносяться артеріальна гіпертензія, дисліпідемія, цукровий діабет, куріння, ожиріння, низька фізична активність, дієтичні фактори. Відповідно до експертного висновку Європейського товариства з атеросклерозу в 2012 році, у чоловіків і жінок 55 років з оптимальним профілем факторів ризику, ймовірність розвитку всіх серцево-судинних подій зменшується більш ніж в 3 рази; серцево-судинної смертності в 6 разів; ризик розвитку ІХС стає в 10 разів меншим, порівняно з пацієнтами, які мають 2 і більше фактори ризику. Результати великих експериментальних, епідеміологічних і клінічних досліджень демонструють тісний зв’язок між порушеннями ліпідного обміну та розвитком атеросклерозу, зростання абсолютних і відносних характеристик смертності від ІХС в прямій залежності від рівня загального холестерину (11, 15). Разом з тим, дослідження останніх років продемонстрували, що близько половини хворих на ІХС мають нормальні рівні ліпідів, у третини з них визначаються підвищені рівні тригліцеридів ( ТГ), зниження рівня холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ ) і практично нормальні концентрації холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ). У цьому зв’язку неабияке практичне значення мають результати популяційного Українсько-Російського дослідження (2009-2013 рр.) з виявлення 20 факторів ризику в міській популяції м. Дніпропетровськ, які продемонстрували, що поширеність гіперхолестеринемії у міській популяції становить в середньому 69,4 % (62,3 % у чоловіків і 71,8 % у жінок), при цьому зареєстровано збільшення даного показника з віком; поширеність підвищеного рівня ХС- ЛПНЩ ( > 3,0 ммоль / л ) була так само досить висока, прогресувала з віком і склала в середньому 68,1 % (68,1 для чоловіків і 66,0 % для жінок). Гіпертригліцеридемія (>1,7 ммоль/л) була виявлена в 31,7 % випадків ( 35,6 % чоловіків і 26,2 % жінок). Як для чоловіків, так і для жінок відзначено збільшення гіпертригліцеридемії з віком з 29,0 % до 33.8 % у чоловіків і більш стрімке – з 13,0 % до 39,7 % у жінок. Поширеність низького рівня ХС- ЛПВЩ ( < 1,0 ммоль / л для чоловіків і < 1,3 ммоль / л для жінок) виявилася не надто характерною рисою для обстеженої популяції. Всього лише 18,3 % респондентів ( 10,4 % чоловіків і 24,6 % жінок) у середньому мали фактор ризику ССЗ у вигляді зниження ХС- ЛПВЩ ( 1 ). Призначення гіполіпідемічних засобів є одним з найважливіших аспектів лікування хворих з дисліпідеміями. Позитивні за прогнозом можливості терапії були продемонстровані в численних клінічних дослідженнях з первинної ( AFCAPS / TexCAPS, ASCOT LLA ) і вторинної ( 4S , LIPID , CARE , HPS ) профілактики атеросклерозу і його ускладнень у хворих з різним ступенем серцево-судинного ризику, з різними показниками холестерину, різної статі і віку , з цукровим діабетом (ЦД ) та іншими еквівалентами ІХС. На жаль, рекомендований цільовий рівень ліпідів не завжди досягається навіть при призначенні найбільш активних статинів і високий кардіоваскулярний ризик залишається після проведення статінотерапіі, що вимагає приєднання інших гіполіпідемічних препаратів. Наявність різідуального кардіоваскулярного ризику було добре проілюстровано в дослідженні Cholesterol Treatment Trialists (4). При проведенні метааналізу 14 досліджень ( 90056 пацієнтів ) було виявлено, що залишковий ризик ІХС був виявлений у хворих, яким проводилася монотерапія статинами. Тому, хоча статини є препаратами вибору, комбінована терапія може бути необхідна для нормалізації всього ліпідного профілю. В даний час увагу привертають препарати, додаткове призначення яких до стандартної гіполіпідемічної терапії, здатні ефективно оптимізувати показники ліпідного профілю, не викликаючи при цьому побічних ефектів. Відповідно до рекомендацій з лікування дисліпідемій Європейського товариства кардіологів та Європейського товариства з атеросклерозу (2011 р.), якщо рівень ТГ не вдається контролювати статинами та фібратами можна призначати омега 3- поліненасичені жирни кислоти (ПНЖК) для подальшого зниження рівня ТГ, адже ці комбінації є безпечними та добре переносяться пацієнтами (клас рекомендацій ІІА, рівень доказовасті В) ( 8 ). Доза для зниження рівня ТГ становить 3-4 гр. на добу в комбінації ейкозапентаєнової – ( ЕПК) і докозагексаєнової ( ДГК ) ПНЖК. Рівень ТГ на такій дозі знижується на 30-40% , а при важкій гипертригліцеридемії (> 500 мг / дл ) – на 45 %, при цьому рівень ХC ЛПВЩ підвищується на 9 %. Що стосується ЛПНЩ, то в більшості випадків цей показник істотно не змінюється на фоні прийому ПНЖК (2, 5). Результати численних досліджень з використанням ПНЖК як ад’ювантного засобу стандартної гіполіпідемічної терапії у пацієнтів високого серцево-судинного ризику продемонстрували, що додавання ЕПК до правастатину або симвастатину в порівнянні з монотерапією статинами зменшувало кількість коронарних подій на тлі відсутності змін рівня загального ХС ( ЗХС) , ХС ЛПНЩ і ХС ЛПВЩ і незначного зниження концентрації ТГ (6,7). Аналіз даних підгруп пацієнтів з високим кардіоваскулярним ризиком, а саме з метаболічним синдромом ( МС ) і характерними для нього підвищеним рівнем ТГ і низьким рівнем ХС ЛПВЩ, продемонстрував зменшення кількості випадків розвитку ІХС. Тому, терапевтичне застосування омега- 3 поліненасичених жирних кислот у міру накопичення даних стає все більш привабливим засобом первинної та вторинної профілактики серцево-судинних захворювань ( ССЗ) (3, 4).
Таким чином, поява на фармацевтичному ринку України вітчизняного препарату «ЕПАДОЛ НЕО» виробництва ПАТ «Київський вітамінній завод», Україна в якості додаткового засобу до стандартної гіполіпідемічної терапії, є актуальним і необхідним. Метою даного дослідження є оцінка ефективності та переносимості препарату «ЕПАДОЛ НЕО» Україна у хворих з гіпертонічною хворобою (ГХ) та метаболічним синдромом.
Матеріали та методи
У дослідження було включено 58 жінок (середній вік – 54,2 ± 2,7 року ) з ГХ та МС, які склали дві клінічні групи: 1-а – 30 пацієнток з ГХ і МС, (індекс маси тіла (ІМТ) 32,5±1,4 кг/м2), яким до стандартної гіполіпідемічної терапії статинами, був додатково призначений препарат «ЕПАДОЛ НЕО» в дозі 2 капсули на добу ; 2-а – 28 пацієнток з ГХ і МС, (індекс маси тіла 31,8±1,8 кг/м2), які приймали тільки терапію статинами. Склад препарату «ЕПАДОЛ НЕО»: 1 капсула містить етилових ефірів омега- 3 ПНЖК 1000 мг, до складу яких входять: ейкозапентаєнова кислота 300 мг; докозагексаєнова кислота 200 мг; інші жирні кислоти 498 мг; d-α–токоферол 2 мг. В якості статинотерапіі пацієнти обох груп приймали аторвастатин «Лівостор» виробництва ПАТ «Київський вітамінній завод» у добовій дозі 10 мг. У всіх пацієнток виявляли гіпертонічну хворобу ІІ стадії, 1-2 ступеня, ризик високий. Анамнез ІХС, інфаркту міокарду був відсутній у всіх учасників дослідження. Діагноз ГХ виставлявся згідно рекомендацій Української асоціації кардіологів з профілактікі та лікування артеріальної гіпертензії 2008 р . Верифікація МС проводилася відповідно до Консенсусу по метаболічному синдрому 2009 р. Всі хворі на протязі дослідження отримували інгібітори ангіотензинперетворюючого ферменту ( лізиноприл в дозі 20-30 мг / добу), петлевий діуретик торасемід ( 2,5-5 мг) , ацетилсаліцилову кислоту 100 мг / сут. Дози препаратів не змінювалися за 1 міс. до включення в дослідження і на всьому його протязі. Відповідно до рекомендацій Української асоціації кардіологів 2011 р. з діагностики, профілактики та лікування дисліпідемій всім пацієнткам була призначена дієтотерапія в перші 3 міс. виявлення дисліпідемій, а саме, зниження вживання жирів тваринного походження, калорійності їжі, також дані рекомендації з модифікації способу життя ( щоденні фізичні навантаження середньої інтенсивності, тривалістю 30 хв . Період спостереження склав 12 тижнів .Методи дослідження включали: розрахунок ІМТ, вимірювання офісного артеріального тиску (АТ) по Короткову після прийому препаратів, визначення основних біохімічних показників сироватки крові натще (АЛТ, АСТ, КФК, креатиніну, глюкози), а також загального ХС, ТГ, ХС ЛПВЩ, ХС ЛПДНЩ, ХС ЛПНЩ, коефіцієнта атерогенності плазми. Проводився імуноферментний аналіз кількісного визначення інсуліну в плазмі крові людини за допомогою набору DRG ® Insмклin з подальшою оцінкою чутливості тканин до інсуліну за допомогою індексу НОМА. Даний показник розраховували за формулою: рівень інсуліну натще (мклОд/мл) × глюкоза крові натще (ммоль / л) / 22,5. При індексі НОМА > 3 ум.од. діагностували ІР. Офісне вимірювання АТ здійснювалося перед прийомом наступної дози антигіпертензивного препарату між 8:00-10:00 ранку. АТ вимірювали в положенні сидячи три рази з інтервалом 2 хвилини. У протокол вносилося середній АТ. Частота серцевих скорочень визначалася після другого вимірювання АТ .Статистичний аналіз результатів проводили з використанням програми SPSS 11.
Результати та обговорення
На початку дослідження показники ліпідного обміну були порівнянні в обох групах. Відмічалось підвищення рівнів загального ЗХС і ХС ЛПНЩ, які були вище цільових показників як для пацієнток високого серцево-судинного ризику (ЗХС <4,5 ммоль / л і ХС ЛПНЩ <2,5 ммоль / л). Також у всіх пацієнток відмічались прояви дісліпідемії, які були характерними для метаболічного синдрому, а самє рівні ТГ перевіщували 1,7 ммоль / л, а івні ХС-ЛПВЩ були нижчими за 1,3 ммоль / л. (табл. 1) Таблиця 1. Динаміка показників ліпідного пофілю на фоні лікування.
| Показники | 1 группа | 2 группа | ||
| Фон | 12 тижнів | фон | 12 тижнів | |
| ЗХС, ммоль/л | 5,4±0,1 | 4,9±0,2 | 5,5±0,2 | 5,0±0,1 |
| ТГ, ммоль/л | 2,2±0,1 | 1,7±0,1٭٭ | 2,1±0,1 | 1,9±0,1 |
| ХС ЛПНЩ, ммоль/л | 3,4±0,1 | 3,2±0,2 | 3,6±0,3 | 3,4±0,3 |
| ХС ЛПВЩ, ммоль/л | 1,18±0,05 | 1,24±0,04 | 1,17±0,11 | 1,21±0,22 |
| ХСЛПДНЩ, ммоль/л | 1,3±0,2 | 1,1±0,1 | 1,3±0,1 | 1,2±0,1 |
| Коеффціент атерогеності | 4,4±0,6 | 3,2±0,4 | 4,3±0,4 | 3,3±0,3 |
Примітка: ** – відмінності показників достовірні у порівнянні з такими на фоні лікування в 1-й групі (Р <0,05);
У пацієнток обох груп в кінці дослідження спостерігалася оптимізація ліпідних характеристик. В обох групах відмічалась тенденція до співставного зниження рівнів загального ХС на 9,3 % і 9,0 % та ХС ЛПНЩ на 5,9 % і 5,5 % відповідно (рис.1). При цьому у жінок 1-ї групи на фоні комбінованої терапії аторвастатином та препаратом «ЕПАДОЛ НЕО» у порівнянні з 2-ю групою відзначалося на більший відсоток (5,1 % проти 3,4 %) підвищення рівнів холестерину ЛПВЩ і достовірне (р <0,05) зниження рівня ТГ (-22,7 % проти 9,5 % ) до цільових значень (1,7 ± 0,1 ммоль / л).
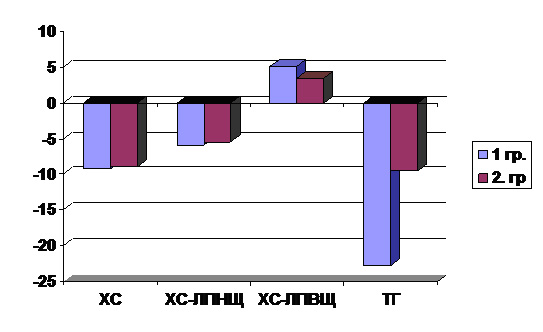
Рисунок 1 . Відсоток змін рівнів показників ліпідного обміну.
На даний час переконливо доведено здатність ПНЖК зменшувати концентрацію тригліцерідів. Його рівень на фоні застосування ПНЖК може знижуватися на 30-40 %, при цьому рівень ХС ЛПВЩ підвіщується на 9 %. Такі ефекти ПНЖК більшість дослідників пов’язують з їх здатністю частково пригнічувати секрецію ЛПДНЩ печінковими клітинами, подовжувати катаболізм хиломикронов в плазмі, знижати секрецію аполіпопротеїну B, а такоже з можлівістю активації гамма-рецептора проліфератора-активатора пероксисом, що приводить в кінцевому рахунку до зниженя синтезу ЛПДНЩ в печінці (9,10 ).
Для оцінки додаткового впливу препарату «ЕПАДОЛ НЕО» в комбінованій терапії з аторвастатином на показники ІР ми провели порівняльний аналіз рівнів глюкози, інсуліну та індексу НОМА до і після 12 тижнів лікування. Як видно з таблиці 2, у пацієнток обох груп на початку дослідження відмічались прояви ІР, визначеної за даними НОМА індексу, 3,3±0,1 та 3,2±0,2 ум. од. відповідно. В основному прояви ІР відмічались за рахунок гіперінсулінемії, яка визначалась в обох групах. В кінці спостереження у 1-й групі відмічена нормалізація чутливості периферичних тканин до інсуліну, що виразилося в зниженні індексу НОМА до 2,2±0,3 ум. од. Даний характер змін, в основному був обумовлений зниженням рівня інсуліну з 14,5±0,2 до 9,7±0,3 мклОд / мл., в той час як у 2-й групі відмічалась тільки тенденція до нормалізації даного показника. Властивість препарату «ЕПАДОЛ НЕО» оптимізувати показники інсуліночутливості, яке виявлено у нашому дослідженні у хворих з ІР підтверджують дані дослідженнь останніх років про важливу роль Омега-3 ПНЖК у сінтезі тканиних гормонів, ейкозаноїдів (простагландини, простацикліни, тромбоксани и лейкотрієні ), що регулюють клітинні та тканинні функції, включаючі чутлівість до інсуліну, запальні реакції, тромбоцитарну актівність, ендотеліальну функцію и т.д. (12, 13).
Через 12 тижнів спостереження в 1-й групі відзначалася більш істотна динаміка зниження показників офісного систолічного і діастолічного АТ (САТ, ДАТ) в порівнянні з 2-ю групою. Хоча достовірних відмінностей у досліджуваних показниках між групами не виявлено, можна відзначити, що додавання омега-3-ПНЖК до стандартної терапії у пацієнток з МС оптимізував антигіпертензивний ефект. У літературі описані можливі механізми розвитку гіпотензивного ефекту омега- 3 – ПНЖК. У дослідженнях показано, що релаксація малих артерій ацетилхолином, взятих від пацієнтів з гіперхолестеринемією, значно поліпшувалася через 3 міс. прийому омега- 3 – ПНЖК (ЕПК + ДГК ) в дозі 3 г / сут. Показано, що добавки ПНЖК покращують ендотеліальну функцію і сприяють підвищенню вироблення оксиду азоту. У своєму метааналізу M.C. Morris і співавтори виявили значуще зниження артеріального тиску на 3,4 / 2,0 мм рт. ст. в дослідженнях у пацієнтів з артеріальною гіпертензією, які вживали омега- 3 – ПНЖК по 5,6 г / добу. Інші дослідники виявили зниження АТ на 5,5 / 3,5 мм рт. ст. у паціентів з нелікованою артеріальної гипертензією при прийомі омега- 3 – ПНЖК > 3 г / добу ( 14, 16).
Таблиця 2. Динаміка показників вуглеводного обміну та офісного артеріального тиску на фоні лікування.
| Показники | 1 група | 2 група | ||
| фон | 12 тижнів | фон | 12 тижнів | |
| САТ, мм рт. ст | 144,2±1,1 | 135,4±1,4 | 143,7±1,3 | 140,1±1,2 |
| Д АТ, мм рт. ст | 95,4±1,3 | 89,1±1,1 | 92,1±1,2 | 90,1±1,1 |
| ЧСС, уд/хв.. | 76,5±2,2 | 70,5±1,2 | 72,5±1,1 | 69,5±1,1 |
| Глюкоза ммоль/л | 5,1±0,2 | 5,0±0,2 | 5,3±0,3 | 5,2±0,2 |
| Інсулін мклОд/мл | 14,5±0,2 | 9,7±0,3 | 13,6±0,6 | 12,5±0,5 |
| Індекс НОМА, ум.од | 3,3±0,1 | 2,2±0,3 | 3,2±0,2 | 2,9±0,2 |
Однак слід зазначити, що зважаючи на необхідність прийому омега- 3 – ПНЖК у високій дозі, необхідній для зниження АТ, використання даного продукту в лікуванні артеріальної гіпертензії відіграє обмежену роль.
Таким чином, приєднання препарату «ЕПАДОЛ НЕО» в дозі 2 капсули на добу до стандартної гіполіпідемічної терапії оптимізує ефективність статинів, що асоціюється з досягненням цільових рівнів ТГ у пацієнок з ГХ та МС поряд з нормалізацією чутливості периферичних тканин до інсуліну та оптимізацією показників офісного АТ.
За час проведення дослідження, терапія препаратом «ЕПАДОЛ НЕО» в дозі 2 капсули на добу добре переносилася пацієнтками і можливі побічні ефекти, як клінічні так і лабораторних показників у порівнянні з вихідними нормативними значеннями були відсутні.
Висновки
- Виявлено, що додавання препарату «ЕПАДОЛ НЕО» в дозі 2 капсули 1 раз на добу до гіполіпідемічної терапії статинами у пацієнток з ГХ та МС протягом 12 тижнів, асоціюється з досягненням цільового рівня ТГ, більшим відсотком підвищення рівня ХС ЛПВЩ і співставною динамікою зниження рівнів ХС і ХС ЛПНЩ в порівнянні з групою, якій проводилася тільки монотерапія статинами .
- Виявлено, що приєднання препарату «ЕПАДОЛ НЕО» в дозі 2 капсули 1 раз на добу до стандартної терапії статинами асоціюється з більш позитивною динамікою офісних САТ і ДАТ та відновленням чутливості периферичних тканин до інсуліну у хворих з ГХ , МС та ІР за даними НОМА-індексу, в той час як у пацієнток на монотерапії статинами відзначалася тільки тенденція до нормалізації даного показника.
- Застосування препарату «ЕПАДОЛ НЕО» в дозі 2 капсули 1 раз на добу продемонструвало високу безпеку і хорошу переносимість даного лікарського препарату поряд з відсутністю побічних реакцій у досліджуваних пацієнток.
Література
- Mitchenko E.I., Mamedov M.N., Kolesnik T.V., Deev A.D. Cardiovascular risk in an urban population in Ukraine. International Heart and Vascular Disease Journal Volume 2, Number 2, February 2014
- Ascherio A., Rimm E.B., Giovannucci E.L. et al. (1996) Dietary fat and risk of coronary heart disease in men: cohort follow up study in the United States. BMJ, 313(7049): 84–90.
- Balk E.M., Lichtenstein A.H., Chung M. et al. (2006) Effects of omega-3 fatty acids on serum markers of cardiovascular disease risk: a systematic review. Atherosclerosis, 189(1): 19–30.
- Baigent C, Keech A, Kearney PM, Blackwell L, Buck G, Pollicino C, Kirby A, Sourjina T, Peto R, Collins R, Simes R, Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet 2005; 366(9493):1267-78
- Burr M.L., Fehily A.M., Gilbert J.F. et al. (1989) Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet, 2(8666): 757–761.
- Connor W.E. (2000) Importance of n-3 fatty acids in health and disease. Am. J. Clin. Nutr., 71(1 Suppl.): 171S–175S.
- Davidson M.H., Stein E.A., Bays H.E. et al.; COMBination of prescription Omega-3 with Simvastatin (COMBOS) Investigators (2007) Efficacy and tolerability of adding prescription omega-3 fatty acids 4 g/d to simvastatin 40 mg/d in hypertriglyceridemic patients: an 8-week, randomized, double-blind, placebo-controlled study. Clin. Ther., 29(7): 1354–1367
- ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS Eur Heart J. 2011 Jul;32(14):1769-818. doi: 10.1093/eurheartj/ehr158. Epub 2011 Jun 28.
- Harris W.S. (1997) ω-3 fatty acids and serum lipoproteins: human studies. Am. J. Clin. Nutr., 65(5 Suppl.): 1645S–1654S.
- Kris-Etherton P.M., Harris W.S., Appel L.J.; American Heart Association. Nutrition Committee (2002) Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation, 106(21): 2747–2757.
- Kromhout D. Serum cholesterol in cross-cultural perspective. The Seven Countries Study. Acta Cardiol. 1999 Jun;54(3):155-8
- Lavie C.J., Milani R.V., Mehra M.R., Ventura H.O. (2009) Omega-3 polyunsaturated fatty acids and cardiovascular diseases. J. Am. Coll. Cardiol., 54(7): 585–594.
- Marchioli R., Valagussa F. (2000) The results of the GISSI-Prevenzione trial in the general framework of secondary prevention. Eur. Heart J., 21(12): 949–952.
- Morris M.C., Sacks F., Rosner B. (1993) Does fish oil lower blood pressure? A meta-analysis of controlled trials. Circulation, 88(2): 523–533.
- Multiple risk factor intervention trial. Risk factor changes and mortality results. Multiple Risk Factor Intervention Trial Research Group. . JAMA. 1982 Sep 24;248(12):1465-7
- Sheard N.F. (1998) Fish consumption and risk of sudden cardiac death. Nutr. Rev., 56(6): 177–179.
Стаття надана мовою оригіналу






