
 Article
Article
 21.02.2025
21.02.2025
Ефективність препарату Новірин у дітей з вірусними діареями
С.О.Крамарьов, В.В.Євтушенко Національний медичний університет ім. О.О.Богомольця; О.М.Євтушенко, Є.А.Маєвська, В.В.Бабак Київська міська дитяча клінічна лікарня №2
В світі щороку серед дітей перших 5 років життя реєструється близько 1,4 мільярдів випадків гострих кишкових інфекцій (ГКІ), серед яких 1,87 мільйонів закінчується летально [3,19]. В Європі на кожну дитину раннього віку припадає 0,5-1,9 епізодів інфекційних діарей [7]. В Україні щорічно реєструється 50-60 тисяч випадків гострих інфекційних діарей у дітей [21].
Переважна більшість (понад 65%) гострих кишкових інфекцій в країнах Європи мають вірусну етіологію. До найбільш поширених збудників кишкових інфекцій належать ротавіруси, які складають 10-35% в загальній структурі гострих кишкових інфекцій, норовіруси (2-20%), аденовіруси (2-10%) [7,16,19].
Основними напрямками лікування гострих кишкових інфекцій вірусної етіології є застосування регідратації та засобів симптоматичної терапії [7]. Проте, існує багато публікацій щодо позитивного впливу противірусних засобів, препаратів активністю на перебіг вірусних діарей. Зокрема відмічено скорочення тривалості діареї на фоні застосування таких препаратів, як КІП, кіпферон, арбідол, циклоферон, гепон та інші [22].
Останніми роками при лікуванні захворювань вірусної етіології у дітей успішно використовується Інозин пранобекс, противірусний засіб з імуномодулюючими властивостями.
Інозин пранобекс стимулює диференціювання Т-лімфоцитів у популяції цитотоксичних Т-клітин (CD8+) та Т-хелперів (CD4). В той же час препарат сприяє дозріванню продукуючих антитіла плазматичних клітин і, таким чином, активуючи гуморальний імунітет [2,17]. Окрім активації імунокомпетентних клітин, інозин проявляє також пряму противірусну дію. Внаслідок вбудовування інозин-оротової кислоти до рибосом ураженої вірусом клітини порушується вірусної нуклеїнової кислоти [15]. Так, у дослідах in vitro була продемонстрована ефективність препарату проти ротавірусної інфекції [14]. Серед інших, інозин проявляє протизапальну дію, блокуючи продукцію прозапальних цитокінів, таких як TNF-α та IL-1β [20].
На цей час накопичений великий досвід використання Інозину пранобексу при різних захворюваннях вірусної природи. Зокрема, препарат проявив свою ефективність в якості засобу профілактики та лікування при гострих респіраторних інфекціях, в терапії підгострого склерозуючого паненцефаліту, цервікальних кондилом, гострого міозиту, вогнищевої алопеції, герпетичної та ВІЛ-інфекції [1,4-6,8-13,18].
Мета клінічного спостереження: оцінка ефективності препарату Новірин (інозин пранобекс) при лікуванні вірусних діарей у дітей.
Матеріал та методи
До клінічного спостереження залучались діти віком від 1 до 18 років, які проходили стаціонарне лікування на клінічній базі кафедри дитячих інфекційних хвороб НМУ ім. О.О.Богомольця.
Критерії включення:
- гостра кишкова інфекція з підтвердженою вірусною етіологією;
- згода пацієнта та батьків на участь у спостереженні.
Критерії виключення:
- тривалість діареї більше 3 діб до моменту госпіталізації;
- наявність хронічної патології, яка може вплинути на тривалість клінічних симптомів, що вивчаються;
- непереносимість інозину пранобексу.
До спостереження було залучено 60 дітей: 30 пацієнтів увійшли до групи А, яка отримувала стандартну терапію та препарат Новірин, та 30 хворих, які отримували тільки стандартну терапію (група В). Вікова та гендерна структура пацієнтів представлена у таблиці 1.
Таблиця 1. Вікова та гендерна структура пацієнтів
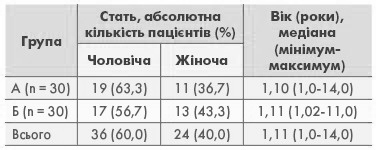
Серед обстежених пацієнтів переважали в обох групах хлопчики. Вік хворих був від 12 місяців до 14 років. За віком та статтю різниця між групами А та В недостовірна (p>0,05 за критерієм Хі-квадрат Пірсона).
До спостереження залучались пацієнти, тривалість захворювання яких на момент госпіталізації не перевищувала 3 діб. Переважна більшість хворих була госпіталізована протягом першої доби захворювання (73,3%). Діти, госпіталізовані протягом третьої доби складали всього 3,3%. Суттєвої різниці між групами з різними методами терапії по днях госпіталізації не відмічалось (p>0,05 за критерієм Хі-квадрат Пірсона).
У всіх хворих (100%), які були залучені до спостереження, тяжкість захворювання оцінювалась як середня.
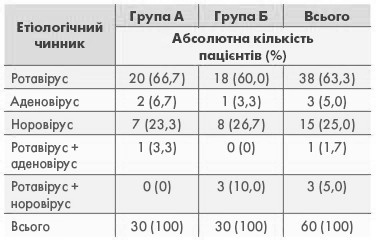
Етіологічну розшифровку проведено за допомогою експрес-тестів CITO TEST ROTA-ADENO для визначення антигенів рота- і аденовірусної інфекцій (фекалії), виробництва ТОВ «Фармаско» (таблиця 2). В етіологічній структурі переважав ротавірус (63,3%), дещо рідше – норовірус (25%) та аденовірус (5%). У 6,7% дітей спостерігалась мікст-інфекція. Суттєвої різниці за етіологічною структурою між групами А та В не відмічалось (p>0,05 за критерієм Хі-квадрат Пірсона).
Таблиця 2. Етіологічна структура хворих
Основні клінічні симптоми захворювання представлені у таблиці 3. Прояви інтоксикації спостерігались у всіх пацієнтів на початку спостереження. Симптоми включали зміни поведінки (в’ялість, млявість, вередливість) та зниження апетиту.
Діарея у всіх пацієнтів мала секреторний характер. Стул був водянистий, інколи містив домішки прозорого слизу. Домішки крові в жодному випадку не виявлялись. Частота стулу майже в половині випадків (49,3%) не перевищувала 5 епізодів на добу, у 37,1% – 6-10 епізодів на добу, у 13,6% – понад 10 дефекацій на добу.
Лихоманка спостерігалась у 73,3% хворих. Серед хворих з лихоманкою у більшості пацієнтів (65,9%) температура тіла коливалась в межах субфебрильних цифр (37–38,50С), у 34,1% дітей спостерігались підвищення до фебрильних цифр (>38,50С). Частіше цей симптом мав місце при ротавірусній та аденовірусній етіології захворювання (84,2% та 100%, відповідно) і лише у 40,0% пацієнтів з норовірусною етіологією (різниця між ротавірусною та норовірусною групами достовірна, p<0,05).
Блювання відмічалось майже у половини (46,7%) обстежених хворих. У більшості випадків (60,6%) це було одно- дворазове блювання. У 27,3% випадків блювання було повторним з кількістю епізодів 3-5 на добу, у 12,1% – понад 5 епізодів на добу. Симптом був представлений в усіх етіологічних групах хворих, окрім груп змішаної етіології з незначною кількістю пацієнтів (ротавірус+аденовірус, ротавірус+норовірус). Достовірно частіше блювання спостерігалось у пацієнтів з норовірусною етіологією захворювання (86,7%), ніж при ротавірусній етіології (36,8%) (p<0,05 за точним критерієм Фішера). Між іншими групами достовірної різниці не відмічалось.
Таблиця 3. Частота основних клінічних симптомів в різних етіологічних групах хворих
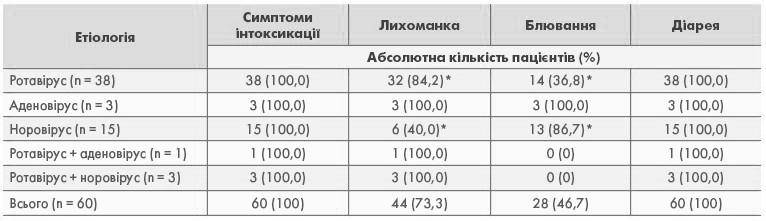
* різниця достовірна між групами «Ротавірус» та «Норовірус» (p<0,05 за точним критерієм Фішера)
У всіх (100%) пацієнтів, які були залучені до спостереження, на фоні лікування спостерігалась позитивна динаміка захворювання і всі були виписані зі стаціонару у задовільному стані. Тривалість основних симптомів захворювання представлена на малюнку 1.
Малюнок 1.
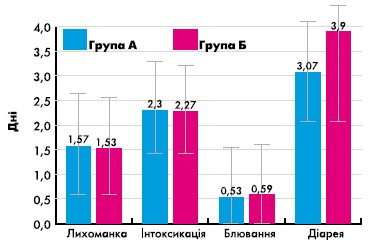
Тривалість лихоманки в середньому складала 1,55 днів. Вона суттєво не відрізнялась у групах з різними методами терапії (p>0,05 за критерієм Манна-Уітні). Інтоксикаційні прояви тривали в середньому 2,28 діб і суттєво не відрізнялись між групами з різними методами терапії (p>0,05). Середня тривалість блювання в загальній сукупності хворих була 0,55 днів. Суттєвої різниці між групами з різними методами терапії не відмічалось (p>0,05). Діарейний синдром в середньому спостерігався протягом 3,58 днів. На 0,83 доби меншою була тривалість діареї у групі, яка отримувала в комплексній терапії препарат Новірин (p=0,008 за критерієм Манна-Уітні).
Динаміка основних клінічних симптомів захворювання при різних методах терапії представлена у таблиці 4. В таблиці по днях спостереження представлена кількість та питома вага пацієнтів, у яких був наявний даний симптом.
Лихоманка на момент госпіталізації спостерігалась у 70% дітей групи А та у 60% – групи В (p>0,05 за критерієм Хі-квадрат Пірсона). Динаміка нормалізації температури тіла в обох групах була схожою. Вже на третю добу перебування у стаціонарі підвищена температура тіла відмічалась лише у 20% хворих групи А та у 16,7% групи В (p>0,05 за критерієм Хі-квадрат Пірсона). На 5-у добу спостереження у всіх пацієнтів реєструвалась нормальна температура тіла.
Блювання на момент госпіталізації спостерігалось у 46,7% дітей групи А та у 40% групи В (p>0,05 за критерієм Хі-квадрат Пірсона). На третю добу спостереження в жодного пацієнта групи А блювання не повторювалось, в групі В у двох дітей відмічались епізоди блювання. Після третього дня в обох групах цей симптом не спостерігався.
Таблиця 4. Динаміка частоти клінічних симптомів у групах з різними методами терапії (n (%))
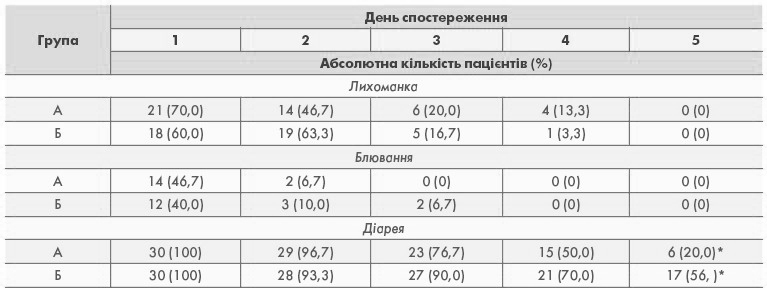
* різниця достовірна між групами A та B (p<0,05 за критерієм Хі-квадрат).
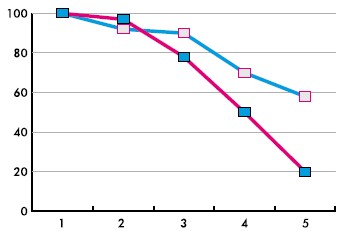
Діарея на момент госпіталізації спостерігалась у всіх (100%) пацієнтів, які були залучені до спостереження (таблиця 3, малюнок 2). З часом зменшення відсотку пацієнтів з діареєю інтенсивніше відбувалось у групі А. Так, на 3-й день спостереження їх частка у групі А була 76,7%, у групі В – 90%; на 4-й день: 50% та 70%, відповідно; на 5-й день: 20% та 56,7%. Різниця на 5-й день спостереження була достовірною (p<0,05 за критерієм Хі-квадрат).
Малюнок 2.
При застосуванні досліджуваного препарату у комплексній терапії жодного побічного явища виявлено не було. Переносимість препарату Новірин в нашому дослідженні була високою.
Висновки:
- В етіологічній структурі вірусних діарей у дітей переважали рота- та норовірус (63,3% та 25,0%, відповідно).
- Призначення препарату Новірин дозволяє припинити діарею в перші 5 днів від початку лікування у достовірно більшого числа дітей (80%), порівняно з контрольною групою (43%).
- Препарат Новірин добре переносився хворими, жодних побічних явищ при його застосуванні не було зареєстровано.
- Експрес-тести на вірусні антигени збудників кишкових інфекцій допомагають швидко встановити етіологічний діагноз та визначити оптимальну лікувальну тактику.
Литература.
- Anlar B. Subacute sclerosing panencephalitis and chronic viral encephalitis. Handb Clin Neurol. 2013;112:1183-9. doi:10.1016/B978-0-444-52910-7.00039-8.
- Aronson JK. Meyler’s. Side Effects of Antimicrobial Drugs. Elsevier; 2010. Available at: https://books.google.com.ua/books?id=aYh5NwAACAAJ.
- Black RE, Cousens S, Johnson HL, et al. Global, regional, and national causes of child mortality in 2008: a systematic analysis. Lancet. 2010;375(9730):1969-87. doi:10.1016/S0140-6736(10)60549-1.
- Georgala S, Katoulis AC, Befon A, Georgala C, Rigopoulos D. Oral inosiplex in the treatment of cervical condylomata acuminata: a randomised placebo-controlled trial. BJOG. 2006;113(9):1088-91. doi:10.1111/j.1471-0528.2006.01041.x.
- Georgala S, Katoulis AC, Befon A, Georgala K, Stavropoulos PG. Inosiplex for treatment of alopecia areata: a randomized placebo-controlled study. Acta Derm Venereol. 2006;86(5):422-4. doi:10.2340/00015555-0138.
- Gołebiowska-Wawrzyniak M, Markiewicz K, Kozar A, et al. Immunological and clinical study on therapeutic efficacy of inosine pranobex. Pol Merkur Lekarski. 2005;19(48 22):379-382.
- Guarino A, Ashkenazi S, Gendrel D, Lo Vecchio A, Shamir R, Szajewska H. ESPGHAN/ESPID Evidence-based Guidelines for the Management of Acute Gastroenteritis in Children in Europe: Update 2014. J Pediatr Gastroenterol Nutr. 2014;39(1):132-152. doi:10.1097/MPG.0000000000000375.
- Gutierrez J, Issacson RS, Koppel BS. Subacute sclerosing panencephalitis: an update. Dev Med Child Neurol. 2010;52(10):901-7. doi:10.1111/j.1469-8749.2010.03717.x.
- Harukawa H, Yuasa T. Progress of the therapy for virus related neurological disorders. Nihon Rinsho. 1997;55(4):959-66. Available at: http://www.ncbi.nlm.nih.gov/pubmed/9103902. Accessed February 8, 2015.
- Hosoya M. Anti SSPE drugs. Nihon Rinsho. 2012;70(4):625-8. Available at: http://www.ncbi.nlm.nih.gov/pubmed/22568144. Accessed February 8, 2015.
- Hosoya M. Subacute sclerosing panencephalitis (SSPE). Rinsho Shinkeigaku. 2011;51(11):1047-50. Available at: http://www.ncbi.nlm.nih.gov/pubmed/22277474. Accessed February 8, 2015.
- Hozyasz KK, Gryglicka H, Radomyska B. Benign acute childhood myositis (BACM)–cases report. Pol Merkur Lekarski. 2009;27(158):129-31. Available at: http://www.ncbi.nlm.nih.gov/pubmed/19856879. Accessed February 8, 2015.
- Iakupova RS, Skachkova MA, Choloian SB, Karpova EG. Efficacy of immunomodulators in children with respiratory diseases in environmentally poor areas. Gig Sanit. 2012;(3):33-4. Available at: http://www.ncbi.nlm.nih.gov/pubmed/23088120. Accessed February 8, 2015.
- Linhares REC, Rebelle M a., Nozawa CM. Effect of isoprinosine on rotavirus replication in vitro. Brazilian J Med Biol Res. 1996;29:219-222.
- Ohnishi H, Kosuzume H, Inaba H, Ohkura M, Shimada S, Suzuki Y. The immunomodulatory action of inosiplex in relation to its effects in experimental viral infections. Int J Immunopharmacol. 1983;5(3):181-96. Available at: http://www.ncbi.nlm.nih.gov/pubmed/6194125. Accessed February 8, 2015.
- Orbuch M. Diarrheal Diseases. Gastroenterol Nurs. 1992;14:316. doi:10.1097/00001610-199206000-00011.
- Stenzel T, Tykałowski B, Smiałek M, Koncicki A, Kwiatkowska-Stenzel A. The effect of different doses of methisoprinol on the percentage of CD4+ and CD8+ T lymphocyte subpopulation and the antibody titers in pigeons immunised against PPMV-1. Pol J Vet Sci. 2011;14(3):367-71. Available at: http://www.ncbi.nlm.nih.gov/pubmed/21957729. Accessed February 8, 2015.
- Thorsen S, Pedersen C, Sandström E, et al. [Controlled, clinical trial of isoprinosine administration to HIV-infected patients. Results of a Danish/Swedish multicenter study. The Scandinavian Isoprinosine Study Group]. Ugeskr Laeger. 1994;156(22):3314-8. Available at: http://www.ncbi.nlm.nih.gov/pubmed/7520643. Accessed February 8, 2015.
- WHO | Diarrhoeal disease. Available at: http://www.who.int/mediacentre/factsheets/fs330/en/. Accessed December 28, 2014.
- Леваков С.А., Кедрова А.Г., . Кажурина Е.В, Ванке Н.С. Синтетические аналоги инозина в современном лечении фоновых и предраковых заболеваний шейки матки // Клиническая практика.- 2010- №3.-С. 43-50.
- Підручник: Інфекційні хвороби в дітей / С.О.Крамарьова, О.Б.Надрага, Л.В.Пипа [та ін.] / За ред. проф. С.О.Крамарьова, О.Б.Надраги.- К.: ВСВ «Медицина».- 2010, с. 392.
- Учайкин В.Ф., Новокшонов А.А., Соколова Н.В. Этиопатогенетическая терапия острых кишечных инфекций у детей на современном этапе /Лечащий врач. – 2010.-N 1.-С.7-13.
Стаття надана мовою оригіналу





